题目内容
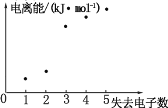
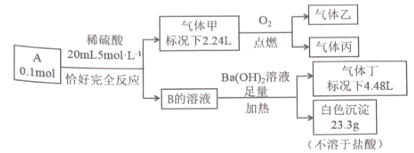
【题目】已知:化合物A 和 B 均是由四种短周期元索组成的离子化合物, 且阳离子相同,A中阴阳离子个数比为1 : 1;气体甲由三种元素组成,标况下密度为2.68gL-1 ,且分子中各原子最外层电子满足8 电子 ;乙和丙为'常见气体,均能使澄清石灰水变浑浊,丙能使品红溶液褪色;气体丁能使湿润的红色石蕊试纸变蓝。化合物A 按如下流程进行实验。
请回答
(1)气体甲的电子式 ______________。
(2)气体丙通入足量硝酸钡溶液中,发生反应的离子方程式为____________。
(3)检验A的水溶液中所含阴离子的实验方法为_________________。
(4)气体甲和气体丙在一定条件下 ________(填 “可能” 或“不可能”) 发生氧化还原反应,若可能请写出你认为合理的化学方程式,若不可能请说明你的理由________________________________。
【答案】![]() 3SO2+3Ba2++2
3SO2+3Ba2++2![]() +2H2O=3 BaSO4↓+2NO↑+4H+ 取少量A 的溶液于试管中,滴加 FeCl3 溶液,若溶液变成血红色,说明含 SCN- 可能 2COS+SO2=3S+2CO2
+2H2O=3 BaSO4↓+2NO↑+4H+ 取少量A 的溶液于试管中,滴加 FeCl3 溶液,若溶液变成血红色,说明含 SCN- 可能 2COS+SO2=3S+2CO2
【解析】
根据题意,乙和丙为'常见气体,均能使澄清石灰水变浑浊,丙能使品红溶液褪色;则丙应为二氧化硫,乙为二氧化碳,甲由三种元素组成,即含有C、S、O三种元素,生成甲标况下的体积为2.24L,密度为2.68gL-1,则质量=2.24L ×2.68gL-1=6g,物质的量为![]() =0.1mol,则甲的摩尔质量=60g/mol,由此可推知甲的化学式为COS,气体丁能使湿润的红色石蕊试纸变蓝,则丁为氨气,物质的量为
=0.1mol,则甲的摩尔质量=60g/mol,由此可推知甲的化学式为COS,气体丁能使湿润的红色石蕊试纸变蓝,则丁为氨气,物质的量为![]() =0.2mol,不溶于盐酸的白色沉淀为硫酸钡,质量为23.3g,即物质的量为
=0.2mol,不溶于盐酸的白色沉淀为硫酸钡,质量为23.3g,即物质的量为![]() =0.1mol,由此可推断B为硫酸铵,根据上述分析,甲中含有0.1molS,B中含有0.1molS,硫酸中S的物质的量为0.02L×5mol/L=0.1mol,故A中含有0.1molS、0.1molC、0.2molN、0.8molH,由C、S、N、H四种元素组成,阴阳离子个数比为1 : 1,化合物A 和 B阳离子相同,则A为NH4SCN,据此分析解答。
=0.1mol,由此可推断B为硫酸铵,根据上述分析,甲中含有0.1molS,B中含有0.1molS,硫酸中S的物质的量为0.02L×5mol/L=0.1mol,故A中含有0.1molS、0.1molC、0.2molN、0.8molH,由C、S、N、H四种元素组成,阴阳离子个数比为1 : 1,化合物A 和 B阳离子相同,则A为NH4SCN,据此分析解答。
(1)根据分析,甲的化学式为COS,由于S和O同主族,结构类似于二氧化碳,气体甲的电子式![]() ;
;
(2)根据分析,丙应为二氧化硫,气体丙通入足量硝酸钡溶液中,二氧化硫可与水作用形成酸性溶液,酸性条件下硝酸根具有强氧化性,发生反应的离子方程式为3SO2+3Ba2++2![]() +2H2O=3BaSO4↓+2NO↑+4H+;
+2H2O=3BaSO4↓+2NO↑+4H+;
(3) A为NH4SCN,有铵根离子和硫氰根离子构成的离子化合物,检验A的水溶液中所含阴离子的实验方法为取少量A 的溶液于试管中,滴加 FeCl3 溶液,若溶液变成血红色,说明含 SCN- ;
(4)甲的化学式为COS,S和O的非金属性越强于C,则得电子能力强于C,则甲中S和O为-2价,S元素处于最低价态具有还原性,丙为二氧化硫,硫元素为+4价具有氧化性,二者在一定条件下可以发生氧化还原反应(归中反应),化学方程式为:2COS+SO2=3S+2CO2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(______)4mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(______)3mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
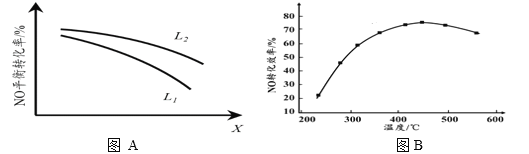
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
【题目】酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如下表所示:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)Fe(OH)3沉淀溶解平衡常数(Ksp)的表达式是什么?__________________。
(2)Fe(OH)3能否溶于稀硫酸?________。试用沉淀溶解平衡理论解释。____________。
(3)常温下,若使FeCl3溶液中的Fe3+沉淀完全,需加入NaOH溶液调整溶液的pH为多少?(离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全)_____________。
(4)向等物质的量浓度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先产生的沉淀是什么?_____________。
(5)若在ZnCl2溶液中混有少量的Fe2+,应如何除去?_________。