题目内容
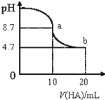
【题目】将NaCl和CuSO4两种溶液等体积混合后用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是

A.整个过程中两电极反应2Cl--2e-=Cl2↑、2H+2e-=H2↑不可能同时发生
B.电解至C点时,往电解质溶液中加入适量CuCl2固体,即可使电解质溶液恢复至原来的浓度
C.AB段表示电解过程中H+被还原,pH增大
D.原混合溶液中NaCl和CuSO4浓度之比恰好为2:1
【答案】A
【解析】
KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解分3个阶段:
[第一阶段]相当于电解氯化铜,阳极:氯离子失电子,阴极:铜离子得电子,因为铜离子水解使溶液显酸性,随着电解的进行,铜离子的浓度降低,酸性减弱,pH将增大;
[第二阶段]阳极:氢氧根离子失电子(来源于水的电离),阴极:仍然为铜离子得电子,因为氢氧根离子消耗,使水溶液中氢离子浓度增大,pH迅速减小;
[第三阶段]阳极:氢氧根离子失电子,阴极:氢离子得电子,它们都来源于水的电离,实质是电解水,导致溶液的体积减小,使溶液中氢离子浓度增大,pH继续减小,以此解答本题。
A.根据以上分析,氯离子反应完,铜离子还剩,所以整个过程中两电极反应:2Cl2e═Cl2↑,2H++2e═H2↑不可能同时出现,故A正确;
B.根据以上分析,电解至C点时,在电解液中应加入CuCl2固体和CuO固体,故B错误;
C.根据以上分析,因为铜离子水解使溶液显酸性,随着电解的进行,铜离子的浓度降低,酸性减弱,pH将增大,故C错误;
D.因为由第二阶段阳极氢氧根离子失电子的同时,阴极仍然为铜离子得电子,所以原混合溶液中KCl和CuSO4的浓度之比不是2:1,故D错误;
故答案为:A。

【题目】酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如下表所示:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)Fe(OH)3沉淀溶解平衡常数(Ksp)的表达式是什么?__________________。
(2)Fe(OH)3能否溶于稀硫酸?________。试用沉淀溶解平衡理论解释。____________。
(3)常温下,若使FeCl3溶液中的Fe3+沉淀完全,需加入NaOH溶液调整溶液的pH为多少?(离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全)_____________。
(4)向等物质的量浓度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先产生的沉淀是什么?_____________。
(5)若在ZnCl2溶液中混有少量的Fe2+,应如何除去?_________。
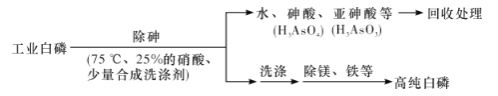
【题目】工业上以硫酸泥(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)为原料提取硒,流程如图:

(1)“脱硫”过程中,温度控制在95℃,原因是___。
(2)“氧化”过程中,Se转化成H2SeO3,该反应的化学方程式为___。
(3)“还原”过程是通过控制电位还原的方法将电位高的物质先还原,电位低的物质保留在溶液中。下表是将“过滤Ⅰ”所得滤液中所含物质还原对应的电位。控制电位在0.782~1.692V,可除去“过滤Ⅰ”所得滤液中残留的ClO2。
名称 | Cu2+/Cu | Zn2+/Zn | Fe2+/Fe | Fe3+/Fe2+ | ClO2/Cl- | H2SeO3/Se |
电位/V | 0.435 | -0.885 | -0.463 | 0.782 | 1.692 | 0.743 |
为使硒和杂质金属分离,加入Na2SO3还原时,电位应控制在___范围;H2SeO3(弱酸)还原为硒的离子反应方程式为___。
(4)滤液Ⅱ中主要存在的金属阳离子有Zn2+、Na+、___。
(5)所得粗硒需精制。向粗硒浸出液中加入Na2S溶液可以将残留的Fe2+等微量杂质离子转化为沉淀而除去。已知25℃时Ksp(FeS)=6.0×10-18,要使溶液中Fe2+沉淀完全[c(Fe2+)≤1.0×10-5mol·L-1],则需控制溶液中c(S2-)≥___mol·L-1。