题目内容
15.短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13.X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素.下列说法正确的是( )| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | 元素Z、W的简单离子的电子层结构不同 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是酸,也可能是盐 |
分析 Z是地壳中含量最高的元素,Z为O;由X的原子半径比Y的小,X与W同主族,短周期元素X、Y、Z、W 的原子序数依次增大,则X一定为第一周期元素,为H,W为Na;原子最外层电子数之和为13,则Y的最外层电子数为13-1-1-6=5,Y为第二周期的N元素,然后结合元素化合物性质及元素周期律来解答.
解答 解:Z是地壳中含量最高的元素,Z为O;由X的原子半径比Y的小,X与W同主族,短周期元素X、Y、Z、W 的原子序数依次增大,则X为H,W为Na;原子最外层电子数之和为13,则Y的最外层电子数为13-1-1-6=5,Y为第二周期的N元素,
A.电子层越多,半径越大,同周期原子序数大的原子半径小,则原子半径为r(W)>r(Y)>r(Z),故A错误;
B.元素Z(O)、W(Na)的简单离子的电子层结构相同,均有2个电子层,最外层电子数为8,故B错误;
C.非金属性Z>Y,则元素Y的简单气态氢化物的热稳定性比Z的弱,故C错误;
D.只含X、Y、Z三种元素的化合物,若为硝酸盐,则为离子化合物,若为硝酸,则是共价化合物,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,把握原子结构的关系推断各元素为解答的关键,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
5. Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)化学反应速率本质上是由反应物本身的性质决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明温度对反应速率有影响,该因素对反应速率的具体影响是:其它条件相同时,温度越高反应速率越快.
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2.0mol/L.
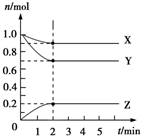
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
(5)反应开始至2min,Y的平均反应速率0.03mol/(L•min).
(6)分析有关数据,写出X、Y、Z的反应方程式X(g)+3Y(g)?2Z(g).
 Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2.0mol/L.
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
(5)反应开始至2min,Y的平均反应速率0.03mol/(L•min).
(6)分析有关数据,写出X、Y、Z的反应方程式X(g)+3Y(g)?2Z(g).
6.甲烷的燃料电池,稀硫酸作电解质溶液,下列说法正确的是( )
| A. | 燃料电池工作时O2在正极上发生氧化反应 | |
| B. | 燃料电池在工作时需要点燃甲烷 | |
| C. | 燃料电池工作时燃料在负极上发生氧化反应 | |
| D. | 燃料电池工作时负极的电极反应式为:2H2O+O2+4e-=4OH- |
3.能说明醋酸是弱电解质的是:( )
①pH=2的醋酸溶液稀释至体积为原来的100倍后pH<4
②稀的醋酸溶液中加入少量的醋酸铵固体,溶液的酸性减弱(醋酸铵溶于水显中性)
③可以用食醋清除热水瓶内的水垢.
①pH=2的醋酸溶液稀释至体积为原来的100倍后pH<4
②稀的醋酸溶液中加入少量的醋酸铵固体,溶液的酸性减弱(醋酸铵溶于水显中性)
③可以用食醋清除热水瓶内的水垢.
| A. | ①③ | B. | ①② | C. | ②③ | D. | 全部 |
10.CH3OH和C2H5OH的混合物与浓H2SO4共热,可能生成的有机物最多有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
20.下列物质在一定条件下能够与硫黄发生反应,且硫做还原剂的是( )
| A. | O2 | B. | Fe | C. | H2 | D. | Hg |
7.下列实验中,不能观察到明显的变化的是( )
| A. | 把氯气通入FeCl2溶液中 | |
| B. | 把绿豆大的钾投入水中 | |
| C. | 把一段打磨过的镁带放入少量冷水中 | |
| D. | 把溴水滴加到KI淀粉溶液中 |
4.将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$ 的值与温度高低有关.当n(KOH)=a mol时,下列有关说法正确的是( )
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=$\frac{1}{5}$ | |
| B. | 参加反应的被还原的氯气为$\frac{1}{4}$amol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$amol≤ne≤$\frac{5}{6}$amol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{5}{6}$amol |
5.下列各组微粒中,都互为等电子体的是( )
| A. | CO、NO、NaH、N2 | B. | SO2、NO2+、N3-、CNO- | ||
| C. | CO32-、NO3-、BeCl2 | D. | SiF4、SiO44-、SO42-、PO43- |