题目内容
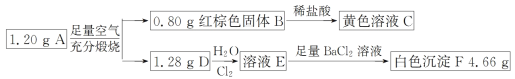
【题目】已知化合物 A 由两种元素组成,某研究小组按如图流程探究其组成,其中 D 是一种能使品红溶液褪色的气体。
请回答下列问题:
(1)化合物 A 的组成元素有______。(填元素符号)
(2)写出 A→B+D 的化学方程式_________。
(3)写出 D→E 的离子方程式________。
【答案】Fe、S 4FeS2+11O2![]() 2Fe2O3+8SO2 SO2+Cl2+2H2O =4H++SO42-+2Cl-
2Fe2O3+8SO2 SO2+Cl2+2H2O =4H++SO42-+2Cl-
【解析】
化合物 A 由两种元素组成,在足量的空气中煅烧产生红棕色固体B和能使品红溶液褪色的气体D,则B是Fe2O3, 可知A中含有Fe元素;气体D与Cl2在水中发生反应,向反应后的溶液中加入足量BaCl2溶液产生白色沉淀F是BaSO4,说明氯水氧化了气体D,反应产生的物质是HCl和H2SO4的混合溶液,反应产生的硫酸钡沉淀质量是4.66g,说明A中含有S元素;因此化合物A是Fe、S两种元素形成的化合物;n(Fe2O3)=![]() =0.005mol,n(Fe)=0.01mol,n(SO2)=n(BaSO4)=
=0.005mol,n(Fe)=0.01mol,n(SO2)=n(BaSO4)=![]() =0.02mol,n(Fe):n(S)= 0.01mol:0.02mol=1:2,所以A是化学式是FeS2。
=0.02mol,n(Fe):n(S)= 0.01mol:0.02mol=1:2,所以A是化学式是FeS2。
(1)由以上分析可知,A组成元素为Fe、S,化学式为FeS2;
(2)FeS2高温煅烧,反应产生Fe2O3和SO2,根据电子守恒、原子守恒,可得反应的化学方程式为4FeS2+11O2![]() 2Fe2O3+8SO2;
2Fe2O3+8SO2;
(3)SO2溶于水,向水溶液中通入氯气,发生氧化还原反应,产生盐酸和硫酸,该反应的离子方程式为:SO2+Cl2+2H2O=4H++SO42-+2Cl-。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目