��Ŀ����
����Ŀ����1������β���е�CO��NO��NO2���ж������Σ�����彡������������β���Ӵ�ת���������ж�����ת��Ϊ�����塣
��֪����2NO(g)+O2(g)=2NO2(g) ��H1=��112.3kJ��mol-1
��NO2(g)+CO(g)=NO(g)+CO2(g) ��H2=��234kJ��mol-1
��N2(g)+O2(g)=2NO(g) ��H3=+179.5kJ��mol-1
��д��CO��NO2��������Ⱦ������Ȼ�ѧ����ʽ___��
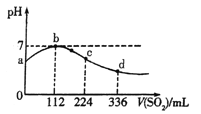
��2������CO��NO����ͬ����Ͷ��һ�ܱ������з�����Ӧ��2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ��H=��759.8kJ��mol-1����Ӧ�ﵽƽ��ʱ��N2�����������n(CO)/n(NO)�ı仯������ͼ1��
N2(g)+2CO2(g) ��H=��759.8kJ��mol-1����Ӧ�ﵽƽ��ʱ��N2�����������n(CO)/n(NO)�ı仯������ͼ1��
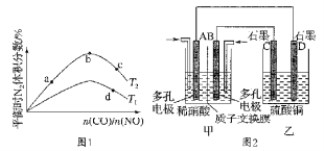
��b��ʱ��ƽ����ϵ��C��Nԭ�Ӹ���֮�Ƚӽ�___��
��a��b��c����CO��ת���ʴӴ�С��˳��Ϊ___��a��c��d�����ƽ�ⳣ���Ӵ�С��˳��Ϊ___��
����n(CO)/n(NO)=0.8����Ӧ��ƽ��ʱ��N2���������Ϊ20������CO��ת����Ϊ__��
��3������NO2��O2ͨ�������Ƴ���ͼ2��ʾװ�ã�D�缫���к�ɫ������������A�缫��ͨ�������Ϊ____(�ѧʽ)��A�缫�ĵ缫��ӦʽΪ____��һ��ʱ������������0.2molCu(OH)2ʹ��Һ��ԭ����ת�Ƶĵ�����Ϊ___��
��4����֪��25��ʱ��H2C2O4�ĵ��볣��Ka1=5.9��10��2��Ka2=6.4��10-5����25��ʱ��0.1mol��L-1NaHC2O4��Һ�и�����Ũ���ɴ�С��˳��Ϊ____���������Һ�м���һ����NaOH���壬ʹc(HC2O4-)=c(C2O42-)�����ʱ��Һ��___(����ԡ������ԡ������ԡ�)��
���𰸡�4CO(g)+2NO2(g)=CO2(g)+N2(g) ��H=��1227.8 kJ��mol-1 1��1 a��b��c a��c��d 75�� NO2 NO2-e-+H2O=NO3-+2H+ 0.8NA c(Na+)��c(HC2O4-)��c(H+)��c(C2O42-)��c(OH-) ����
��������
(1)���ݸ�˹����,�ɢ���4+��-�ۿɵ�4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g)����H=(-234 kJ��mol-1)��4-112.3 kJ��mol-1-179.5 kJ��mol-1= -1 227.8 kJ��mol-1��
4CO2(g)+N2(g)����H=(-234 kJ��mol-1)��4-112.3 kJ��mol-1-179.5 kJ��mol-1= -1 227.8 kJ��mol-1��
����4CO(g)+2NO2(g)=CO2(g)+N2(g) ��H=��1227.8 kJ��mol-1��
(2)�ٵ���Ӧ�ﰴ��ѧ������֮�ȼ���ʱ��ƽ��ʱN2������������b��ʱƽ����ϵ��C��Nԭ�Ӹ���֮�Ƚӽ�1��1��
����1��1
������n(CO)/n(NO)��CO��ת���ʽ��ͣ�����ת����:a>b>c��ƽ�ⳣ��ֻ���¶��йأ�����a����c���ƽ�ⳣ��K��ͬ���÷�ӦΪ���ȷ�Ӧ������ƽ�������ƶ���N2�����������С������T1>T2��d���ƽ�ⳣ��С��a���c�㡣
����a��b��c��a��c��d��
����CO��ʼ���ʵ���Ϊ0.8 mol,��Ӧ��ƽ��ʱ��COת����x mol������:
2CO(g)+2NO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
n��ʼ��/mol 0.8 1 0 0
n��ת����/mol x x ![]() x
x
n��ƽ��/mol 0.8-x 1-x ![]() x
x
ƽ��ʱ��N2���������Ϊ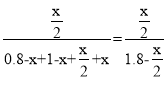 ��100%=20%�����x=0.6�����ԣ�CO��ת����Ϊ
��100%=20%�����x=0.6�����ԣ�CO��ת����Ϊ![]() ��100%=75%��
��100%=75%��
����75%��
(3)��Ϊԭ��أ���Ϊ���أ�D�缫���к�ɫͭ����,��AΪ������A�缫��ͨ��NO2,����������Ӧ���缫��ӦʽΪNO2-e-+H2O![]() NO3-+2H+�����ʱ�����ȵ������ͭ�����ֵ��ˮ��������������0.2 mol Cu(OH)2��ʹ��Һ��ԭ����ת�Ƶ�����Ϊ(0.2��2+0.2��2)NA=0.8NA��
NO3-+2H+�����ʱ�����ȵ������ͭ�����ֵ��ˮ��������������0.2 mol Cu(OH)2��ʹ��Һ��ԭ����ת�Ƶ�����Ϊ(0.2��2+0.2��2)NA=0.8NA��
����NO2 ��NO2-e-+H2O=NO3-+2H+ ��0.8NA��
(4) HC2O4-��ˮ�ⳣ��Kh=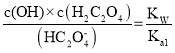 =
=![]() =1.69��10-13��Kh<Ka2��˵��HC2O4-��ˮ��̶�С�������̶ȣ����Ը�����Ũ�ȴ�С˳��Ϊc(Na+)��c(HC2O4-)��c(H+)��c(C2O42-)��c(OH-)����c(HC2O4-)= c(C2O4
=1.69��10-13��Kh<Ka2��˵��HC2O4-��ˮ��̶�С�������̶ȣ����Ը�����Ũ�ȴ�С˳��Ϊc(Na+)��c(HC2O4-)��c(H+)��c(C2O42-)��c(OH-)����c(HC2O4-)= c(C2O4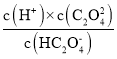 ֪��c(H+)=Ka2=6.4��10-5 mol��L-1>c(OH-)����Һ�����ԡ�
֪��c(H+)=Ka2=6.4��10-5 mol��L-1>c(OH-)����Һ�����ԡ�
��Ϊ��c(Na+)��c(HC2O4-)��c(H+)��c(C2O42-)��c(OH-)�����ԡ�