题目内容
【题目】二氧化碳减排和再利用技术是促进工业可持续发展和社会环保的重要措施。将工业废气中的二氧化碳转化为甲醇,其原理是:
CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=a kJ·mol1
H2O(g)+CH3OH(g) ΔH=a kJ·mol1
2H2(g)+O2(g)=2H2O(l) ΔH=b kJ·mol1
H2O(g)=H2O(l) ΔH=c kJ·mol1
(1)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH =______kJ·mol1
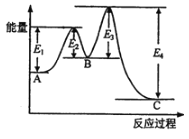
(2)H2(g)+1/2O2(g)=1/2H2O(l)的过程如下图所示,H-O键的键能是______kJ·mol1。

(3)某化学兴趣小组用甲醇燃料电池来模拟铝制品表面“钝化”处理过程(装置如图甲所示)。a电极发生的电极反应方程式为______。实验结束后若硫酸溶液质量减少1.08 g,则石墨电极处生成的气体在标准状况下的体积为______L。

(4)一种Na-CO2二次电池装置如图乙所示,NaClO4溶于有机溶剂作为电解液,电池的总反应为3CO2+4Na![]() 2Na2CO3+C。充电时的阳极反应式为______。
2Na2CO3+C。充电时的阳极反应式为______。
(5)海水中含有大量的HCO3-,一种利用海水提取CO2的装置如图丙所示。结合方程式简述提取CO2的原理:______。
【答案】3b-2a-2c 463.4 CH3OH-6e+H2O=CO2↑+6H+ 1.344 2CO32-+C-4e=3CO2 a室为阳极,电解水,失电子产生氧气和氢离子,电极方程式为:2H2O-4e—=4H++O2↑,H+通过阳离子膜进入海水,与碳酸氢根离子反应生成二氧化碳,发生反应:HCO3-+H+=CO2↑+H2O
【解析】
(1)已知①CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=a kJ·mol1
H2O(g)+CH3OH(g) ΔH=a kJ·mol1
②2H2(g)+O2(g)=2H2O(l) ΔH=b kJ·mol1
③H2O(g)=H2O(l) ΔH=c kJ·mol1
根据盖斯定律,②×3-①×2-③×2,可得2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH =3b kJ·mol1- 2a kJ·mol1-2c kJ·mol1=(3b-2a-2c)kJ·mol1;
答案为:3b-2a-2c。
(2)根据图示:H2(g)+![]() O2(g)=2 H (g)+O(g) ΔH1=+685 kJ·mol1,2 H (g)+O(g)= H2O(g) ΔH2,H2O(g)= H2O(l) ΔH3=-44 kJ·mol1,H2(g)+
O2(g)=2 H (g)+O(g) ΔH1=+685 kJ·mol1,2 H (g)+O(g)= H2O(g) ΔH2,H2O(g)= H2O(l) ΔH3=-44 kJ·mol1,H2(g)+![]() O2(g)= H2O(l) ΔH4=-285.8 kJ·mol1;根据盖斯定律,结合图示可得:ΔH1+ΔH2+ΔH3=ΔH4,即685 kJ·mol1+ΔH2+(-44 kJ·mol1)=(-285.8 kJ·mol1),则ΔH2=-926.8 kJ·mol1,H-O键的键能是
O2(g)= H2O(l) ΔH4=-285.8 kJ·mol1;根据盖斯定律,结合图示可得:ΔH1+ΔH2+ΔH3=ΔH4,即685 kJ·mol1+ΔH2+(-44 kJ·mol1)=(-285.8 kJ·mol1),则ΔH2=-926.8 kJ·mol1,H-O键的键能是![]() ×926.8 kJ·mol1=463.4 kJ·mol1,
×926.8 kJ·mol1=463.4 kJ·mol1,
答案为:463.4。
(3)用甲醇燃料电池来模拟铝制品表面“钝化”处理,则铝为电解池阳极,失电子发生氧化反应,变为氧化铝和氢离子,石墨为电解池阴极,氢离子得到电子转化为氢气,则b为原电池正极,a为原电池负极;燃料电池中燃料在负极发生反应,故a电极发生的电极反应方程式为CH3OH-6e+H2O=CO2↑+6H+;电解池中,阳极反应式为3H2O +2Al -6e-= Al2O3+6H+,阴极电极式为6H++6e-= 3H2↑,根据电极反应,硫酸溶液质量减少1.08 g为水的质量,3H2O~3H2,则产生的氢气的物质的量=消耗水的物质的量=![]() mol,标况下的体积为
mol,标况下的体积为![]() mol×22.4L/mol=1.344L。
mol×22.4L/mol=1.344L。
答案为:1.344。
(4)根据电池的总反应3CO2+4Na![]() 2Na2CO3+C,充电时,阳极失电子,根据反应方程式,2CO32-+C-4e=3CO2,
2Na2CO3+C,充电时,阳极失电子,根据反应方程式,2CO32-+C-4e=3CO2,
答案为:2CO32-+C-4e=3CO2。
(5)a室为阳极,电解水,失电子产生氧气和氢离子,电极方程式为:2H2O-4e—=4H++
答案为:a室为阳极,电解水,失电子产生氧气和氢离子,电极方程式为:2H2O-4e—=4H++O2↑,H+通过阳离子膜进入海水,与碳酸氢根离子反应生成二氧化碳,发生反应:HCO3-+H+=CO2↑+H2O。

 优等生题库系列答案
优等生题库系列答案