题目内容
3.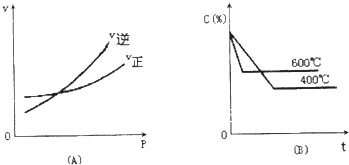 如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.图(A)为温度一定时,压强与反应速率的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.图(A)为温度一定时,压强与反应速率的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合两个图象的反应是( )| A. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-808.7kJ/mol | |
| B. | N2O3(g)?NO2(g)+NO(g)△H=+41.8kJ/mol | |
| C. | 3NO2(g)+H2O(l)?2HNO3(l)+NO(g)△H=-261.3kJ/mol | |
| D. | CO2(g)+C(s)?2CO(g)△H=+171.4kJ/mol |
分析 由图Ⅰ可知,到达平衡后,增大压强逆反应速率增大更大,平衡向逆反应移动,说明气体反应物的化学计量数之和小于气体生成物的化学计量数之和,由图Ⅱ可知,温度越高平衡时反应物的百分含量越高,说明升高温度,平衡向逆反应移动,故正反应为放热反应,据此结合选项解答.
解答 解:由图Ⅰ可知,到达平衡后,增大压强逆反应速率增大更大,平衡向逆反应移动,说明气体反应物的化学计量数之和小于气体生成物的化学计量数之和,由图Ⅱ可知,温度越高平衡时反应物的百分含量越高,说明升高温度,平衡向逆反应移动,故正反应为放热反应,
A、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-808.7kJ/mol,正反应是气体物质的量增大的反应,且正反应是放热反应,符合反应特征,故A符合;
B、N2O3(g)?NO2(g)+NO(g)△H=+41.8kJ/mol,正反应是气体物质的量增大的反应,但正反应是吸热反应,不符合反应特征,故B不符合;
C、3NO2(g)+H2O(l)?2HNO3(aq)+NO(g)△H=-261.3kJ/mol,反应前后气体物质的量不变,正反应是放热反应,不符合反应特征,故C不符合;
D、CO2(g)+C(s)?2CO(g)△H=+171.4KJ/mol,正反应是吸热反应,不符合反应特征,故D不符合;
故选A.
点评 本题考查化学平衡移动图象,难度中等,把握图象中曲线的变化特点分析可逆反应的特征是解答该题的关键.

练习册系列答案
相关题目
14.乙烯(C2H4)、乙酸(C2H4O2)和甲醛(CH2O)组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为( )
| A. | 27% | B. | 28% | C. | 54% | D. | 无法计算 |
11.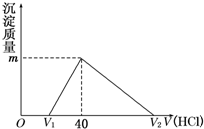 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )| A. | 原合金质量为0.92g | B. | 产生氢气0.04mol | ||
| C. | 图中m值为1.56g | D. | 图中V2为60 mL |
8.下列不能使溴水完全褪色的是( )
| A. | 乙烯 | B. | 氢氧化钾溶液 | C. | 二氧化硫 | D. | KI溶液 |
15.设NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A. | 53g Na2C03固体中含有的离子数总数为1.5NA | |
| B. | 78 g Na2O2与足量的水充分反应,转移的电子数目为NA | |
| C. | 46 g NO2 和 N2O4混合气体中含有原子数为3NA | |
| D. | 在标准状况下,22.4 L SO3中含原子数为4 NA |
12.从左到右,原子半径由小到大且最高正价依次降低的是( )
| A. | N、O、F | B. | Si、P、Cl | C. | Na、Cl、S | D. | Al、Mg、Na |
13.对于数以千万计的化学物质和为数更多的化学反应,分类的作用几乎是无可替代的.下列物质分类的正确组合是( )
| 混合物 | 化合物 | 单质 | 盐 | |
| A | 盐酸溶液 | NaOH溶液 | 石墨 | 食盐 |
| B | 水玻璃 | KNO3晶体 | O3 | 纯碱 |
| C | 氢氧化铁胶体 | 澄清石灰水 | 铁 | 石灰石 |
| D | CuSO4•5H2O | CaCl2 | 水银 | CaO |
| A. | A | B. | B | C. | C | D. | D |
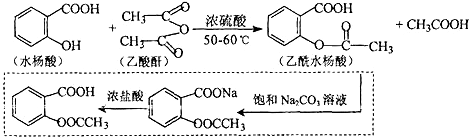
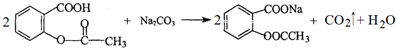 .
.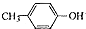 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: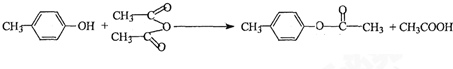 .
.