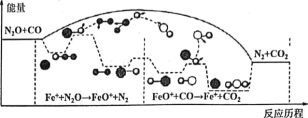
题目内容
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体中原子间通过______________________作用形成面心立方密堆积,其中M原子的配位数____________。
(2)元素Y的含氧酸中,酸性最强的是________________(写化学式),该酸根离子的立体构型为______________________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
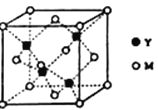
①该化合物的化学式为______________________,已知晶胞参数a=0.542 nm,此晶体的密度为__________________________g·cm–3。(只写出计算式,阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是:_____________________________________。
【答案】金属键 12 HClO4 正四面体 CuCl ![]() Cu+可与氨形成易溶于水的配位化合物(或配离子)
Cu+可与氨形成易溶于水的配位化合物(或配离子)
【解析】
M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子,则M是Cu元素;面心立方密堆积中,离铜原子最近且距离相等的铜原子有12个;(2)元素Y的负一价离子的最外层电子数与次外层的相同,则Y是Cl元素;ClO4-中氯原子的价电子对数是![]() ,无孤电子对;(3) ①根据均摊原则计算晶胞的化学式;1个晶胞含有4个铜原子、4个氯原子,所以晶胞的摩尔质量是4×99.5g/mol;晶胞参数a=0.542 nm,则1个晶胞的体积是(0.542×10-7)3cm3;②Cu+可与氨形成易溶于水的配位化合物。
,无孤电子对;(3) ①根据均摊原则计算晶胞的化学式;1个晶胞含有4个铜原子、4个氯原子,所以晶胞的摩尔质量是4×99.5g/mol;晶胞参数a=0.542 nm,则1个晶胞的体积是(0.542×10-7)3cm3;②Cu+可与氨形成易溶于水的配位化合物。
M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子,则M是Cu元素,Cu是金属单质,所以原子间通过金属键形成面心立方密堆积;晶体中离铜原子最近且距离相等的铜原子有12个,所以Cu的配位数是12;(2)元素Y的负一价离子的最外层电子数与次外层的相同,则Y是Cl元素;氯元素的含氧酸中,酸性最强的是HClO4;ClO4-中氯原子的价电子对数是![]() ,无孤电子对,所以ClO4-的立体构型为正四面体;(3) ①根据均摊原则,晶胞中铜原子数是
,无孤电子对,所以ClO4-的立体构型为正四面体;(3) ①根据均摊原则,晶胞中铜原子数是![]() ,氯原子数是4,所以该化合物的化学式为CuCl;1个晶胞含有4个铜原子、4个氯原子,所以晶胞的摩尔质量是4×99.5g/mol;晶胞参数a=0.542 nm,则1个晶胞的体积是(0.542×10-7)3cm3,晶体的密度为
,氯原子数是4,所以该化合物的化学式为CuCl;1个晶胞含有4个铜原子、4个氯原子,所以晶胞的摩尔质量是4×99.5g/mol;晶胞参数a=0.542 nm,则1个晶胞的体积是(0.542×10-7)3cm3,晶体的密度为![]() g·cm–3;②Cu+可与氨形成易溶于水的配位化合物,所以CuCl难溶于水但易溶于氨水。
g·cm–3;②Cu+可与氨形成易溶于水的配位化合物,所以CuCl难溶于水但易溶于氨水。

【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1