题目内容
【题目】下列叙述正确的是( )
A.20.0g![]() 溶解在1L水中,所得溶液的物质的量浓度为
溶解在1L水中,所得溶液的物质的量浓度为![]()
B.从1L![]() 溶液中取出0.5L,取出的溶液浓度为
溶液中取出0.5L,取出的溶液浓度为![]()
C.配制1L![]() 溶液,需用5.85g
溶液,需用5.85g![]() 固体
固体
D.常温常压下,将2.24L![]() 气体溶于水制得100mL溶液,其物质的量浓度为
气体溶于水制得100mL溶液,其物质的量浓度为![]()
【答案】C
【解析】
A. 物质的量浓度c=![]() , 20.0g
, 20.0g![]() 溶解在1L水中形成的溶液体积未知,无法计算物质的量浓度,故A错误;
溶解在1L水中形成的溶液体积未知,无法计算物质的量浓度,故A错误;
B.溶液是均一稳定的分散系,从1L![]() 溶液中取出0.5L,取出的溶液浓度为
溶液中取出0.5L,取出的溶液浓度为![]() ,故B错误;
,故B错误;
C. 1L![]() 溶液中溶质的物质的量为n=1L×0.1mol/L=0.1mol,质量为m=0.1mol×58.5g/mol=5.85g,故C正确;
溶液中溶质的物质的量为n=1L×0.1mol/L=0.1mol,质量为m=0.1mol×58.5g/mol=5.85g,故C正确;
D.常温常压下,2.24L![]() 气体的物质的量不是0.1mol,故D错误;
气体的物质的量不是0.1mol,故D错误;
故答案为 C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
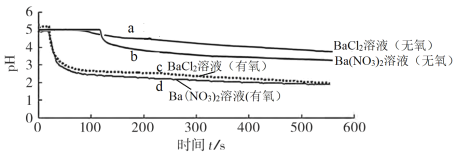
【题目】将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的 BaCl2溶液和Ba(NO3)2溶液中,探究体系中微粒间的相互作用,实验记录如下:
实验记录 | |
pH变化 |
|
溶液中是否产生沉淀 | BaCl2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀 Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀 |
下列说法不正确的是
A.曲线a 所示溶液pH降低的原因:SO2 + H2O![]() H2SO3
H2SO3![]() H+ + HSO3-
H+ + HSO3-
B.曲线c 所示溶液中发生反应:2Ba2+ + O2 + 2SO2 + 2H2O =2BaSO4↓+ 4H+
C.与曲线a、b、c对比,可知曲线d所表示的过程中NO3-是氧化SO2的主要微粒
D.依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2