ЬтФПФкШн
ЁОЬтФПЁПШмвКжаЕФЛЏбЇЗДгІДѓЖрЪЧРызгЗДгІЁЃИљОнвЊЧѓЛиД№ЯТСаЮЪЬтЃК
(1)бЮМюЕи(КЌНЯЖрNa2CO3ЁЂNaCl)ВЛРћгкжВЮяЩњГЄЃЌЪдгУЛЏбЇЗНГЬЪН(ЛђРызгЗНГЬЪН)ЫЕУїЃК
бЮМюЕиВњЩњМюадЕФдвђЃК______________________________ЃЛ
(2)ЧыгУРызгЗНГЬЪНБэЪОУїЗЏОЛЫЎЕФдРэЃК_______________________
(3)ШєШЁpHЁЂЬхЛ§ОљЯрЕШЕФNaOHШмвККЭАБЫЎЗжБ№гУЫЎЯЁЪЭmБЖЁЂnБЖЃЌЯЁЪЭКѓpHШдЯрЕШЃЌдђm________n(ЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБ)ЁЃ
(4)25ЁцЪБЃЌНЋamolЁЄLЃ1АБЫЎгы0.01molЁЄLЃ1бЮЫсЕШЬхЛ§ЛьКЯЃЌЗДгІЦНКтЪБШмвКжаc(NH4+)=c(Cl-)ЃЌдђШмвКЯд________ад(ЬюЁАЫсЁБЁАМюЁБЛђЁАжаЁБ)ЁЃ
(5)ШчЭМЫљЪОЃЌдкЬњШІКЭвјШІЕФКИНгДІЃЌгУвЛИљУоЯпНЋЦфаќдкЪЂЫЎЕФЩеБжаЃЌЪЙжЎЦНКтЃЛаЁаФЯђЩеБжабыЕЮШыCuSO4ШмвКЃЌЦЌПЬКѓПЩЙлВьЕНЕФЯжЯѓЪЧ_____________ЁЃ
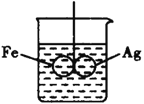
A.ЬњШІКЭвјШІзѓгввЁАкВЛЖЈ B.ЬњШІКЭвјШІБЃГжЦНКтзДЬЌ
C.ЬњШІЯђЯТЧуаБЃЌвјШІЯђЩЯЧуаБ D.вјШІЯђЯТЧуаБЃЌЬњШІЯђЩЯЧуаБ
аДГівјШІЩЯЕФЕчМЋЗДгІЪНЃК__________________ЁЃ
ЁОД№АИЁПCO32-+H2O![]() HCO3-+OH- Al3++3H2O
HCO3-+OH- Al3++3H2O![]() Al(OH)3+3H+ < жа D Cu2++2e-=Cu
Al(OH)3+3H+ < жа D Cu2++2e-=Cu
ЁОНтЮіЁП
(1)ИљОнбЮЕФЫЎНтЙцТЩЗжЮіЃЛ
(2)УїЗЏЪЧЧПЫсШѕМюбЮЃЌдкШмвКжаТСРызгЫЎНтВњЩњЕФЧтбѕЛЏТСНКЬхПЩвдЦ№ОЛЫЎзїгУЃЛ
(3)вЛЫЎКЯАБЪЧШѕЕчНтжЪЃЌМгЫЎЯЁЪЭДйНјвЛЫЎКЯАБЕчРыЃЛ
(4)ИљОнЕчКЩЪиКуЗжЮіЃЛ
(5)ЬњШІКЭвјШІСЌНгНўШыСђЫсЭШмвКжаЃЌИУзАжУЙЙГЩСЫдЕчГиЃЌНЯЛюЦУЕФН№ЪєзїИКМЋЃЌНЯВЛЛюЦУЕФН№Ъєзїе§МЋЃЌИљОне§ИКМЋЩЯЗЂЩњЕФЕчМЋЗДгІХаЖЯЗДгІЯжЯѓЁЃ
(1)ЬМЫсФЦЪЧЧПМюШѕЫсбЮЃЌЬМЫсИљРызгЫЎНтЕМжТШмвКГЪМюадЃЌЫЎНтЗДгІЕФЗНГЬЪНЮЊЫЎНтЗНГЬЪНЮЊCO32-+H2O![]() HCO3-+OH-ЃЛ
HCO3-+OH-ЃЛ
(2)УїЗЏЪЧЧПЫсШѕМюбЮЃЌдкШмвКжаAl3+ЗЂЩњЫЎНтзїгУЃКAl3++3H2O![]() Al(OH)3(НКЬх)+3H+ЃЌЫЎНтВњЩњЕФЧтбѕЛЏТСНКЬхБэУцЛ§ДѓЃЌЮќИНСІЧПЃЌФмЙЛЮќИНЫЎжааќИЁЕФЙЬЬхЮяжЪЃЌЪЙжЎаЮГЩГСЕэЖјЪЙЫЎОЛЛЏЃЌвђДЫПЩвдЦ№ОЛЫЎзїгУЃЛ
Al(OH)3(НКЬх)+3H+ЃЌЫЎНтВњЩњЕФЧтбѕЛЏТСНКЬхБэУцЛ§ДѓЃЌЮќИНСІЧПЃЌФмЙЛЮќИНЫЎжааќИЁЕФЙЬЬхЮяжЪЃЌЪЙжЎаЮГЩГСЕэЖјЪЙЫЎОЛЛЏЃЌвђДЫПЩвдЦ№ОЛЫЎзїгУЃЛ
(3)вЛЫЎКЯАБЪЧШѕЕчНтжЪЃЌМгЫЎЯЁЪЭДйНјвЛЫЎКЯАБЕчРыЃЌNaOHЪЧЧПЕчНтжЪЃЌЭъШЋЕчРыЃЌвЊЪЙpHЯрЕШЕФАБЫЎКЭNaOHШмвКЯЁЪЭКѓpHШдШЛЯрЕШЃЌдђАБЫЎЯЁЪЭБЖЪ§ДѓгкNaOHЃЌМДm<nЃЛ
(4)25ЁцЪБЃЌНЋamolЁЄL-1АБЫЎгы0.01molЁЄL-1бЮЫсЕШЬхЛ§ЛьКЯЃЌЖўепЗЂЩњЗДгІЃЌЗДгІКѓШмвКжаКЌгаH+ЁЂNH4+ЁЂOH-ЁЂCl-ЃЌШмвКжаДцдкЕчЕчКЩЪиКуЃКc(NH4+)+c(H+)=c(OH-)+c(Cl-)ЃЌгЩгкЗДгІЦНКтЪБШмвКжаc(NH4+)=c(Cl-)ЃЌдђШмвКжаc(H+)=c(OH-)ЃЌЫљвдШмвКЯджаадЃЛ
(5)ЬњШІКЭвјШІСЌНгНўШыСђЫсЭШмвКжаЃЌИУзАжУЙЙГЩСЫдЕчГиЃЌНЯЛюЦУЕФН№ЪєFeзїИКМЋЃЌНЯВЛЛюЦУЕФН№ЪєAgзїе§МЋЃЌИКМЋЩЯЬњЪЇЕчзгЩњГЩбЧЬњРызгНјШыШмвКЃЌЕчМЋЗДгІЪНЮЊЃКFe-2e-=Fe2+ЃЌЫљвдЬњШІжЪСПМѕЩйЃЛвјШІЩЯЭРызгЕУЕчзгЩњГЩЭЕЅжЪИНзХдквјШІЩЯЃЌвјШІЩЯЕФЕчМЋЗДгІЪНЮЊЃКCu2++2e-=CuЃЌвјИНзХЃЌЕМжТвјШІжЪСПдіМгЃЌЫљвдЙлВьЕНЕФЯжЯѓЪЧЃКЬњШІЯђЩЯЧуаБ,вјШІЯђЯТЧуаБЃЌЙЪКЯРэбЁЯюЪЧDЁЃ

 ЬєеН100ЕЅдЊМьВтЪдОэЯЕСаД№АИ
ЬєеН100ЕЅдЊМьВтЪдОэЯЕСаД№АИ УћЬтН№ОэЯЕСаД№АИ
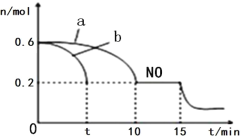
УћЬтН№ОэЯЕСаД№АИЁОЬтФПЁПвбжЊЗДгІЃК2HBr(g)![]() Br2(g)+H2(g)ЃЌдкЫФжжВЛЭЌЕФЬѕМўЯТНјааЃЌBr2ЁЂH2Ц№ЪМЕФХЈЖШЮЊ0ЃЌЗДгІЮяHBrЕФХЈЖШЃЈmol/LЃЉЫцЗДгІЪБМфЃЈminЃЉЕФБфЛЏЧщПіШчЯТБэЃК
Br2(g)+H2(g)ЃЌдкЫФжжВЛЭЌЕФЬѕМўЯТНјааЃЌBr2ЁЂH2Ц№ЪМЕФХЈЖШЮЊ0ЃЌЗДгІЮяHBrЕФХЈЖШЃЈmol/LЃЉЫцЗДгІЪБМфЃЈminЃЉЕФБфЛЏЧщПіШчЯТБэЃК
ЪЕбщађКХ | ЪЕбщЮТЖШ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800Ёц | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800Ёц | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800Ёц | C3 | 0.92 | 0.63 | 0.60 | 0.60 | 0.60 | |
4 | 820Ёц | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
ЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.ДгЩЯБэЪ§ОнЗжЮіЃЌ2HBr(g)![]() Br2(g)+H2(g)е§ЗДгІЮЊЗХШШЗДгІ
Br2(g)+H2(g)е§ЗДгІЮЊЗХШШЗДгІ
B.ЪЕбщ2жаHBrЕФГѕЪМХЈЖШC2ЃН1.0 mol/L
C.ЪЕбщ3ЗДгІЫйТЪаЁгкЪЕбщ1ЕФЗДгІЫйТЪ
D.ЪЕбщ4вЛЖЈЪЙгУСЫДпЛЏМС