题目内容
1.实验室需要使用950mL 0.1mol•L-1的NaCl溶液,试回答下列问题:(1)配制时应选用的容量瓶的规格和需用托盘天平称取NaCl的质量分别是D
A.1000mL,58.5g B.950mL,55.6g C.950mL,5.85g D.1000mL,5.9g
(2)下列仪器中,不会用到的是ABGH
A.锥形瓶 B.950mL容量瓶 C.烧杯 D.胶头滴管 E.1000mL容量瓶 F.天平
G.烧瓶 H.分液漏斗
若要实施配制,除上述仪器外,尚缺的仪器或用品是玻璃棒和药匙.
(3)在使用容量瓶前必须检查容量瓶是否完好以及是否漏水.在容量瓶上必须标明的有D
①容量 ②刻度线 ③温度 ④压强 ⑤物质的量浓度 ⑥用于配制酸溶液或碱溶液
A.只有③⑤⑥B.只有①③⑤C.只有②④⑥D.只有①②③
(4)人们常将氢氧化钠溶液配制过程简述为以下各步骤:
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
其正确的操作顺序应是BEAGCDF(填各步骤序号).
(5)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操
作会导致所得溶液浓度偏高的是B
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处.
分析 (1)容量瓶只有一条刻度线,只能配制与其规格相对应的体积的溶液,根据实验室常用的容量瓶的规格有100mL、250mL、500mL、1000mL来选择;根据选用的容量瓶的规格,即为所配制出的溶液的体积,根据所需的氯化钠的质量m=CVM来计算;
(2)根据用固体来配制一定物质的量浓度的溶液的步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析所需的仪器和缺少的仪器;
(3)容量瓶不能受热,只能配制出与其规格相对应的体积的溶液,据此分析;
(4)根据用固体来配制一定物质的量浓度的溶液的步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析步骤;
(5)根据C=$\frac{n}{V}$结合配制过中的操作对物质的量和溶液体的影响来分析;
解答 解:(1)容量瓶只有一条刻度线,只能配制与其规格相对应的体积的溶液,而实验室常用的容量瓶的规格有100mL、250mL、500mL、1000mL,故950mL 0.1mol•L-1的NaCl溶液,应选用1000mL容量瓶;根据选用的容量瓶的规格为1000mL,即所配制出的溶液的体积为1000mL,故所需的氯化钠的质量m=CVM=0.1mol/L×1L×58.5g/mol=5.85g≈5.9g,故选D;
(2)由于选用的是1000mL容量瓶,然后根据用固体来配制一定物质的量浓度的溶液的步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有:托盘天平、药匙、烧杯、玻璃棒、1000mL容量瓶、胶头滴管,故不会用到的是ABGH,还需要的是玻璃棒和药匙,故答案为:ABGH;玻璃棒和药匙;
(3)容量瓶不能受热,只能配制出与其规格相对应的体积的溶液,故在容量瓶上标有温度、唯一一条刻度线和容量,故选D;
(4)根据用固体来配制一定物质的量浓度的溶液的步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作步骤为BEAGCDF,故答案为:BEAGCDF;
(5)A.定容时仰视容量瓶刻度线,会导致溶液体积偏大,则浓度偏低,故A错误;
B.定容时俯视容量瓶刻度线,会导致溶液体积偏小,则浓度偏高,故B正确;
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作,缺少了洗涤的步骤,会导致溶质的损失,则所配溶液的浓度偏低,故C错误;
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线是正常的,便补充几滴水至刻度处会引起浓度偏低,故D错误.
故选B.
点评 本题考查了配制一定物质的量浓度溶液过程中的计算和误差分析等内容,熟练掌握实验原理是解题关键,难度不大.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案| A. | 羟基的电子式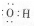 | B. | 醛基官能团符号-COH | ||
| C. | 乙醇的分子式:CH3CH2OH | D. | 异丁烷的结构简式:CH3CH(CH3)CH3 |
| A. | 有使湿润的pH试纸变蓝的气体产生 | |
| B. | 滴有水滴的玻璃片冻结在烧杯底部 | |
| C. | 盛有饱和硝酸钾溶液的试管置于反应混合物内,拿出后发现溶液浑浊 | |
| D. | 烧杯外壁有水珠凝结 |
| A.Cl2与CH4取代反应后的产物: | 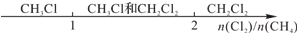 |
| B.向烧碱液中通入SO2后的产物: |  |
| C.铁与稀硝酸反应: | 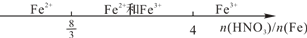 |
| D.向AlCl3溶液中滴加NaOH溶液,铝元素的存在形式: |  |
| A. | A | B. | B | C. | C | D. | D |
| A. | 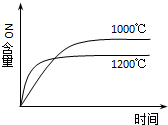 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 | |
| B. | 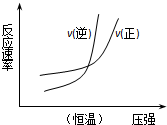 N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 | |
| C. | 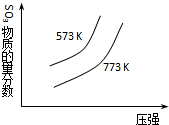 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 | |
| D. | 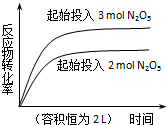 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 |
| A. | X是正极 | B. | Y是正极 | ||
| C. | Y极发生还原反应 | D. | 电子由X极移向Y极 |