题目内容
6.某大学研制成功的新型碱性聚合物电解质燃料电池,有望大幅降低燃料电池汽车的造价.该甲醇燃料电池在NaOH介质中的反应为2CH3OH+3O2+4NaOH═2Na2CO3+6H2O,已知电池的效率与反应速率成正比.不同条件下用不同物质表示的反应速率如下,其中对应的电池效率最高的是( )| A. | v(CH3OH)=0.3 mol•(L•min)-1 | B. | v(O2)=0.4 mol•(L•min)-1 | ||
| C. | v(NaOH)=0.5 mol•(L•min)-1 | D. | v(Na2CO3)=0.01 mol•(L•s)-1 |
分析 由于电池的效率与反应速率成正比,故电池效率最高的即反应速率最大的.
把单位统一成相同单位,再各物质的反应速率之比等于其计量数之比,先把不同物质的反应速率换算成同一物质的反应速率进行比较,从而确定选项.
解答 解:A、v(CH3OH)=0.3 mol•(L•min)-1;
B、v(O2)=0.4 mol•(L•min)-1,则换算成v(CH3OH)=$\frac{2}{3}$v(O2)=$\frac{0.8}{3}$ mol•(L•min)-1≈0.27mol•(L•min)-1;
C、v(NaOH)=0.5 mol•(L•min)-1,则换算成v(CH3OH)=$\frac{1}{2}$v(NaOH)=0.25mol•(L•min)-1;
D、v(Na2CO3)=0.01 mol•(L•s)-1=0.6 mol•(L•min)-1,则换算成v(CH3OH)=v(Na2CO3)=0.6 mol•(L•min)-1.
综上分析可知,反应速率最快的是D,即电池效率最高的是D.故选D.
点评 本题考查学生对化学反应速率及其表示法的理解及应用,此类习题的解题方法是:把不同物质的反应速率换算成同一物质的反应速率进行比较,注意单位是否相同.

练习册系列答案
相关题目
16.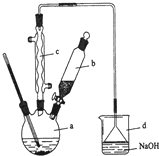 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:
(1)写出实验室合成溴苯的化学反应方程式: +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr.
+HBr.
(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.由b向a中滴入几滴溴,有白雾产生,是因为生成了气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)写出实验室合成溴苯的化学反应方程式:
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr.
+HBr.(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.由b向a中滴入几滴溴,有白雾产生,是因为生成了气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
14.在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是( )
| A. | 氯化铁 | B. | 碳酸氢钠 | C. | 硫酸铝 | D. | 高锰酸钾 |
1.根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
| A. | 锗可用于制造半导体材料 | |
| B. | RbOH的碱性强于Ca(OH)2 | |
| C. | SrCO3是白色难溶于水易溶于盐酸的化合物 | |
| D. | 砹化银(AgAt)是白色难容于稀硝酸的化合物 |
18.化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
| A. |  根据图可判断可逆反应 A2(g)+3B2 (g)?3C(g)+D(s) 的△H>0 | |
| B. |  图表示压强对可逆反应2A (g)+2B (g)?2AB3 (g)的影响,乙的压强大 | |
| C. |  图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| D. |  图④是N2与H2合成氨的能量变化曲线,可确定该反应1 molN2和4mol H2充分反应时放热一定小于92kJ |
15.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,32克 O2与O3所含的原子数目相同,均为NA | |
| B. | 46克的NO2和N2O4混合气体中含原子数目为3 NA | |
| C. | 18克的NH4+中含有电子数为NA | |
| D. | 28 g Fe变为离子时,失去的电子数一定为NA |
16.如图为“铁链”图案,根据铁链上物质的分类依据,在M处应填入的物质是( )

| A. | CaCl2 | B. | Cl2O | C. | Cl2 | D. | NaClO3 |
