题目内容
15.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 常温常压下,32克 O2与O3所含的原子数目相同,均为NA | |
| B. | 46克的NO2和N2O4混合气体中含原子数目为3 NA | |
| C. | 18克的NH4+中含有电子数为NA | |
| D. | 28 g Fe变为离子时,失去的电子数一定为NA |
分析 A、氧气和臭氧均由氧原子构成;
B、NO2和N2O4的最简式均为NO2;
C、求出铵根离子的物质的量,然后根据铵根离子为10电子微粒来分析;
D、根据铁反应后可能变为+2价也可能变为+3价来分析.
解答 解:A、氧气和臭氧均由氧原子构成,故32g无论是氧气还是臭氧中含有的氧原子的物质的量均为n=$\frac{32g}{16g/mol}$=2mol,即2NA个,故A错误;
B、NO2和N2O4的最简式均为NO2,故46g混合气体中含有的NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含3mol原子即3NA个,故B正确;
C、18g铵根离子的物质的量为1mol,而铵根离子为10电子,故1mol铵根离子中含10mol电子即10NA个,故C错误;
D、由于反应后铁可能变为+2价也可能变为+3价,故28g铁即0.5mol铁反应后失去的电子可能为NA个,也可能为1.5NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
5.甲酸甲酯水解反应方程式为:HCOOCH3(1)+H2O(1)?HCOOH(1)+CH3OH(1)△H>0某温度下,V L混合体系中各组分的起始量如下表,HCOOCH3转化率随反应时间t的变化如图(假设混合体系体积不变).下列说法正确的是( )

| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

| A. | 温度升髙,该反应的平衡常数减小 | |
| B. | 0〜10min,HCOOCH3的平均反应速率v=0.003mol•L-1min-1 | |
| C. | HCOOCH3水解平均反应速率先是增大,后减小,最后保持不变 | |
| D. | 该条件下达到平衡状态,反应物转化率相等 |
6.某大学研制成功的新型碱性聚合物电解质燃料电池,有望大幅降低燃料电池汽车的造价.该甲醇燃料电池在NaOH介质中的反应为2CH3OH+3O2+4NaOH═2Na2CO3+6H2O,已知电池的效率与反应速率成正比.不同条件下用不同物质表示的反应速率如下,其中对应的电池效率最高的是( )
| A. | v(CH3OH)=0.3 mol•(L•min)-1 | B. | v(O2)=0.4 mol•(L•min)-1 | ||
| C. | v(NaOH)=0.5 mol•(L•min)-1 | D. | v(Na2CO3)=0.01 mol•(L•s)-1 |
3.下列关于有机化合物的说法正确的是( )
| A. | 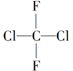 和 和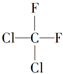 是两种不同的物质 是两种不同的物质 | |
| B. | 聚氯乙烯的单体为CH2═CHCl | |
| C. | 乙烷和乙烯均能使酸性KMnO4溶液褪色 | |
| D. | 1 mol乙酸与足量乙醇在浓硫酸催化下加热,可生成1 mol乙酸乙酯 |
10.下列关于钠的叙述正确的是( )
| A. | 将4.6 g金属钠放入95.4 g蒸馏水中,可得到溶质质量分数为8%的溶液 | |
| B. | 金属钠与水的反应实质上是与水电离产生的H+反应 | |
| C. | 将金属钠投入饱和NaCl溶液中,会有晶体析出,钠的性质活泼,故应保存在CCl4中 | |
| D. | 做有关钠的性质实验时,剩余的Na不用放回原试剂瓶 |
20.下列溶液中Cl-浓度最小的是( )
| A. | 200ml 2mol/L Mg Cl2溶液 | B. | 1000 ml 2.5 mol/LNaCl | ||
| C. | 300 ml 5 mol/L K Cl 溶液 | D. | 250 ml 1 mol/L AlCl3 |
7.某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):
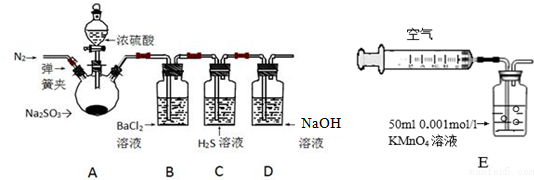
(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化 性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
(7)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样.并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验.请计算该空气中SO2的体积分数(用含V的代数式表示)$\frac{2.8}{V}$.

(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化 性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管中,滴入几滴酚酞 | 溶液变红 |
| 2 |
4.关于炔烃的描述中正确的是( )
| A. | 分子组成符合CnH2n-2通式的链烃一定是炔烃 | |
| B. | 炔烃既易发生加成反应,又易发生取代反应 | |
| C. | 炔烃既能使溴水褪色,也能使酸性高锰酸钾溶液褪色 | |
| D. | 炔烃分子里所有的碳原子都在同一条直线上 |
5.下列哪种物质所含原子数与0.3molH2O2所含原子数相等( )
| A. | 0.6molCaO | B. | 0.2molH2SO4 | C. | 0.15molH3PO4 | D. | 0.4molMgCl2 |