��Ŀ����
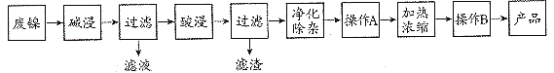
����Ŀ��������������Ҫ��Ni������Al��Fe��SiO2�������������ᡢ������ʡ����÷��������Ʊ�NiSO4��7H2O���壬��������ͼ��
��֪��Ksp[Fe(OH)3]=8.0��10��38��Ksp[Fe(OH)2]=8.0��10��16��Ksp[Al(OH)3]=3.2��10��34��Ksp[Ni(OH)2]=2.0��10��15��1g2=0.3��
�ش���������
��1�������ʱ���������ӷ���ʽΪFe+2H+=Fe2++H2����____��
��2��������������Ҫ�ȼ���H2O2��Һ��������Ӧ�����ӷ���ʽΪ___��
��3��Ni2+��ǿ������Һ�л��ɱ�NaClO����ΪNiOOH���÷�Ӧ���ӷ���ʽΪ___��
���𰸡�Ni+2H+=Ni2++H2����OH-+H+=H2O H2O2+2Fe2++2H+=2Fe3++2H2O 2Ni2++4OH-+ClO-=2NiOOH��+Cl-+H2O
��������
���������Ʊ�NiSO47H2O���������Ϊ�����������ȼ����Al��SiO2������Ӧ��Ni��Fe�������������ᡢ������ʲ���Ӧ�����˳�ȥ��Һ�õ�����Ni��Fe���������ʣ���������ܽ�������Ŀ���ǵõ�NiSO47H2O���������������µ����ʣ�Ӧ��Ϊ���ᣬ��������Ϊ�������������ʣ���Һ�к���Ni2+��SO42-��Fe2+��������������Ҫ�ȼ���H2O2��Һ������������˫��ˮ��������Fe2(SO4)3��������ӦΪ2Fe2++H2O2+2H+=2Fe3++2H2O��������ҺpHʹ������ת������������������ͨ������A���˳�ȥ����������NiSO4��Һ����NiSO4��Һ����Ũ������ȴ�ᾧ�����˵õ�NiSO47H2O���壬�ݴ˽��
(1)�����ʱ���������ֱ��������NaOH��Fe��Ni������Ӧ�����������ӷ���ʽ�ֱ�ΪOH+H+=H2O��Fe+2H+=Fe2++H2����Ni+2H+=Ni2++H2����
(2)���������������H2O2��Һ����Ŀ����������Fe2+ΪFe3+��Fe3+�����γ�Fe(OH)3�Ӷ��ﵽȥ��FeԪ�ص�Ŀ�ģ�������ӦΪ��2Fe2++H2O2+2H+=2Fe3++2H2O��
(3)NiSO4��ǿ������Һ�пɱ�NaClO����ΪNiOOH��ClO����ԭΪCl�����ݵ����غ���ƽ�÷�Ӧ�����ӷ���ʽӦΪ��2Ni2++ClO+4OH=2NiOOH��+Cl+H2O��

����Ŀ����������(![]() )����һ�ָ�Ч�������������ɱ��������������Ũ������������Ƶã�ʵ��װ�úͲ������£�
)����һ�ָ�Ч�������������ɱ��������������Ũ������������Ƶã�ʵ��װ�úͲ������£�
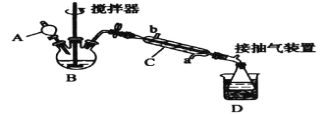
����������ƿ�м���һ������������Ũ����Ļ����ٻ�����������30%��˫��ˮ��
�ڲ��Ͻ��貢����װ��B�л��Һ���¶�Ϊ20��30������Ӧ������
�۽�������C�ͳ����ã�����ƿ���ռ��õ���Ʒ��
�ش��������⣺
��1������C��������____������C����ˮ�������____(����a������b��)��
��2��Ϊ���õؿ��Ʒ�Ӧ�¶ȣ�Ӧ���õļ��ȷ�����_____��
��3�����ɹ�������Ļ�ѧ����ʽΪ____��
��4��ʵ���ò����������İٷֺ����淴Ӧ������ͷ�Ӧʱ��ı仯�������±����ɱ������ݿ�֪����Ӧ����ѱ���(CH3COOH/H2O2)��_____����ѷ�Ӧʱ��Լ_____��
��Ӧ�����CH3COOH/H2O2 | ��Ӧʱ�� | ||||
0.5h | 1h | 3h | 5h | 7h | |
2��1 | 7.38% | 8.46% | 9.42% | 11.26% | 13.48% |
1��1 | 0.56% | 12.92% | 13.54% | 20.72% | 20.80% |
1��2 | 6.14% | 7.10% | 7.96% | 10.38% | 12.36% |
��5����Ʒ�й�������Ũ�ȵIJⶨ��ȡ2.00mL���������Ʒ��������ˮϡ�ͳ�100mL������ȡ��5.00mL����εμ�����KMnO4��Һ����Һǡ�óʷۺ�ɫ���Գ�ȥ�����H2O2���ټ����Թ�����KI��Һ��������ӦCH3COOOH��2I-��2H+=I2��CH3COOH��H2O����Ӧ��ȫ���뼸�ε�����Һ����0.1000mol��L-1��Na2S2O3��Һ�ζ����յ�(��ӦʽΪ2S2O32-��I2=S4O62-��2I-