题目内容
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是_____________________________。
(2)有一铁的氧化物样品,用5mol/L盐酸140mL恰好完全溶解,所得溶液还能吸收标况下560mL氯气,Fe2+全部变成Fe3+,则该样品中Fe 和O 的个数比为_____________。
(3)某研究性学习小组用Fe2(SO4)3溶液腐蚀绝缘板上的铜,制造印刷电路板,为测定Fe2(SO4)3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则可检出待测液中含有的金属阳离子是_____;
②验证该溶液中含有Fe2+,正确的实验方法是__________(用字母代号填)。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
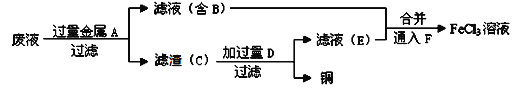
①滤渣C的主要成分的化学式为___________________________________。
②加过量D发生反应的离子方程为__________________________________。
③通入F发生反应的化学方程式为 __________________________________。
【答案】 用丁达尔效应 5:7 Fe3+ B Fe Cu 2H++Fe===Fe2++H2↑ 2FeCl2+Cl2===2FeCl3
【解析】(1)因FeCl3溶液是溶液,无丁达尔现象,而Fe(OH)3胶体是胶体,有丁达尔现象,所以鉴别FeCl3溶液和Fe(OH)3胶体中最简单有效的是观察是否产生了丁达尔现象(效应),故答案为:用平行光照射两种分散系(或丁达尔效应);
(2)n(HCl)=0.14L×5mol/L=0.7mol,n(Cl2)= ![]() =0.025mol,反应中HCl的H元素与氧化物中O元素全部结合生成H2O,则氧化物中n(O)=
=0.025mol,反应中HCl的H元素与氧化物中O元素全部结合生成H2O,则氧化物中n(O)= ![]() ×n(HCl)=
×n(HCl)= ![]() ×0.7mol=0.35mol,反应后溶液成分为FeCl3,n(Cl-)=0.7mol+0.025mol×2=0.75mol,则n(Fe)=0.75mol×
×0.7mol=0.35mol,反应后溶液成分为FeCl3,n(Cl-)=0.7mol+0.025mol×2=0.75mol,则n(Fe)=0.75mol×![]() =0.25mol,所以:n(Fe):n(O)=0.25mol:0.35mol=5:7,故答案为:5:7;
=0.25mol,所以:n(Fe):n(O)=0.25mol:0.35mol=5:7,故答案为:5:7;
(3)①Fe2(SO4)3溶液与铜反应的离子方程式是:2Fe3++Cu═2Fe2++Cu2+;由于滴入KSCN溶液呈红色,证明溶液中Fe3+,故答案为:Fe3+;
②A、显示浅绿色的不一定是亚铁离子,观察溶液是否呈浅绿色,不能证明溶液中含有Fe2+,故A错误;B、向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+;故B正确;C、试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,不能证明原溶液中含有Fe2+,应该是先加入硫氰化钾,不变色,再加入氯水,若显示红色,证明有亚铁离子,故C错误;故选B;
(4)制取的是氯化铁溶液,金属A是铁;滤液B是氯化亚铁溶液;加入的铁过量,滤渣C是铁和铜;制取的是氯化铁,溶解铁,D加入应该是盐酸;
①滤渣C的化学式为Fe、Cu,故答案为:Fe、Cu;
②加过量盐酸发生反应的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
③是将亚铁离子氧化成三价铁离子,反应方程式是:2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案