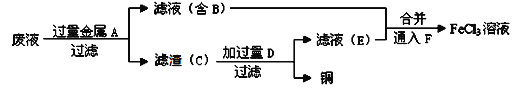
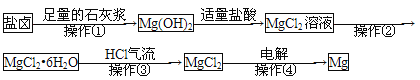
��Ŀ����
����Ŀ����һ��2L���ܱ������У�������Ӧ2SO3��g��2SO2��g��+O2��g������H��0������SO3�ı仯��ͼ��ʾ�� 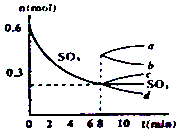
��1����O2��ʾ0��8min�ڸ÷�Ӧ��ƽ������v= ��
��2�������¶ȣ�Kֵ���������������ƽ����Է��������� �� ���������С�����䡱��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����
a��v��SO3��=2v��O2�� b��������ѹǿ���ֲ���
c��v����SO2��=2v����O2�� d���������ܶȱ��ֲ���
��4����8min��ѹ������Ϊ1L����SO3�ı仯����Ϊ
A.a
B.b
C.c
D.d��
���𰸡�
��1��0.0125 mol/��L?min��
��2������С
��3��bc
��4��A
���������⣺��1����ͼ��֪��0��8min��SO3����0.6mol��0.2mol=0.4mol��v��SO3��= ![]() =0.025 mol/��Lmin�����������֮�ȵ��ڻ�ѧ������֮�ȼ�����O2��ʾ0��8min�ڸ÷�Ӧ��ƽ������v=0.025 mol/��Lmin����
=0.025 mol/��Lmin�����������֮�ȵ��ڻ�ѧ������֮�ȼ�����O2��ʾ0��8min�ڸ÷�Ӧ��ƽ������v=0.025 mol/��Lmin���� ![]() =0.0125 mol/��Lmin�������Դ��ǣ�0.0125 mol/��Lmin������2���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���K����ƽ�������ƶ���������������䣬����������ʵ��������������������ƽ����Է�����������С�����Դ��ǣ�����С����3��a��v��SO3��=2v��O2��������ȷ�����淴Ӧ���ʵĹ�ϵ�������ж�ƽ�⣬�ʲ�ѡ��
=0.0125 mol/��Lmin�������Դ��ǣ�0.0125 mol/��Lmin������2���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���K����ƽ�������ƶ���������������䣬����������ʵ��������������������ƽ����Է�����������С�����Դ��ǣ�����С����3��a��v��SO3��=2v��O2��������ȷ�����淴Ӧ���ʵĹ�ϵ�������ж�ƽ�⣬�ʲ�ѡ��
b���÷�ӦΪǰ������������ȵķ�Ӧ����������ѹǿ���ֲ��䣬�ﵽƽ��״̬����ѡ��
c��v����SO2��=2v����O2������֪���淴Ӧ������ȣ�Ϊƽ��״̬����ѡ��
d��������������䣬���������ܶ�ʼ�ձ��ֲ��䣬�����ж�ƽ�⣬�ʲ�ѡ��
���Դ��ǣ�b c����4����8min��ѹ������Ϊ1L��˲�����������������ƽ�������ƶ����������������������С��0.6mol��ֻ��a���ϣ����Դ��ǣ�a��
�����㾫�������û�ѧƽ��ļ������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

����Ŀ��������������������Һ���й���������ȷ���ǣ� ��
�� | �� | �� | �� | |
pH | 11 | 11 | 3 | 3 |
��Һ | ��ˮ | NaOH��Һ | ���� | ���� |
A.�ֱ��ˮϡ��10����������Һ��pH�٣��ڣ��ܣ���
B.�ټ����������Ȼ�茶������Һ��pH��С
C.����Һ��c��NH4+��+c��H+�����ڢ��е�c��Cl����+c��OH����
D.VaL����VbL����Һ��Ϻ�����Ϻ���ҺPH=4����Va��Vb=11��9