题目内容
【题目】请根据如下实验过程,回答相关问题:
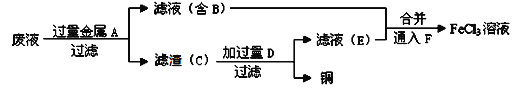
![]()
(1)向A溶液中滴入几滴KSCN溶液后可观察到的现象是_______________________。
(2)写出反应①的化学方程式_________________________________。
写出反应②的离子方程式_________________________________。
【答案】 溶液变为血红色 Fe2O3+6HCl===2FeCl3+3H2O 2Fe3++Fe===3Fe2+
【解析】氧化铁与盐酸反应生成氯化铁和水,得到的A溶液为FeCl3溶液,加入足量铁粉,与FeCl3反应生成FeCl2,B溶液为FeCl2溶液,在B溶液中通入足量氧气的同时加入NaOH溶液,反应生成Fe(OH)3沉淀,所以C固体为Fe(OH)3。
(1). A溶液中含有Fe3+,向A溶液中滴入几滴KSCN溶液,可观察到溶液变为血红色,故答案为:溶液变为血红色;
(2). 由上述分析可知,反应①是氧化铁与盐酸反应生成氯化铁和水,化学方程式为Fe2O3+6HCl=2FeCl3+3H2O,反应②是铁粉与FeCl3反应生成FeCl2,离子方程式为2Fe3++Fe=3Fe2+,故答案为:Fe2O3+6HCl=2FeCl3+3H2O;2Fe3++Fe=3Fe2+。

练习册系列答案
相关题目