题目内容
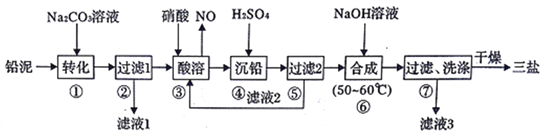
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。
请回答下列问题:
(1)步骤①转化的目的是_________,滤液1中的溶质为Na2CO3和______(填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是____________________。(任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为____________。
(3)滤液2中可循环利用的溶质为__________(填化学式)。若步骤④沉铅后的滤液中c(Pb2+)=1.82×l0-5mol ·L-1,则此时c(SO42-)________mol·L-1。
(4)步骤⑥合成三盐的化学方程式为_________。若得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__________。简述步骤⑦洗涤沉淀的方法_______________________。
【答案】 将PbSO4化为PbCO3提高铅的利用率 Na2SO4 适当升温(或适当增大硝酸浓度或减小沉淀粒直径等其他合理答案) 3Pb + 8H++2NO3 =3Pb2+ +2NO↑+4H2O2 HNO3 1.0×10 3 4PbSO4 +6NaOH ![]() 3Na2SO4+3PbO PbSO4 H2O + 2H2O 52% 用胶头滴管向漏斗中加蒸馏水至没过沉淀,待水自然流完后,重复上述操作2 - 3次。
3Na2SO4+3PbO PbSO4 H2O + 2H2O 52% 用胶头滴管向漏斗中加蒸馏水至没过沉淀,待水自然流完后,重复上述操作2 - 3次。
【解析】(1)步骤①铅泥在碳酸钠溶液中转化生成硫酸钠和碳酸铅,其目的是将PbSO4化为PbCO3提高铅的利用率;滤液1中的溶质为Na2CO3和Na2SO4;(2)影响化学反应速率的外界因素有温度、浓度、压强、催化剂、反应物的接触面积等,根据化工生产实际情况,步骤③酸溶时,为提高酸溶速率,可采取的措施是适当升温(或适当增大硝酸浓度或减小沉淀直粒径等;铅与硝酸反应生成Pb(NO3)2、水和NO,其反应离子方程式为:3Pb + 8H++2NO3- =3Pb2+ +2NO↑+4H2O;(3)酸溶时生成硝酸铅,硝酸铅在沉铅时与硫酸发生复分解反应生成硫酸铅和硝酸,则滤液2中可循环利用的溶质为HNO3,若步骤④沉铅后的滤液中c(Pb2+)=1.82×l0-5mol·L-1,则此时根据Ksp(PbSO4)=c(Pb2+)c(SO42-)可知, c(SO42-)=![]() =1.0×10-3mol·L-1;(4)步骤⑥在50-60℃条件下硫酸铅与氢氧化钠合成三盐的化学方程式为:4PbSO4 +6NaOH
=1.0×10-3mol·L-1;(4)步骤⑥在50-60℃条件下硫酸铅与氢氧化钠合成三盐的化学方程式为:4PbSO4 +6NaOH ![]() 3Na2SO4+3PbO PbSO4 H2O + 2H2O;假设铅泥中的铅元素有80%转化为三盐,若得到纯净干燥的三盐49.5t,则铅泥中铅元素的质量分数为:
3Na2SO4+3PbO PbSO4 H2O + 2H2O;假设铅泥中的铅元素有80%转化为三盐,若得到纯净干燥的三盐49.5t,则铅泥中铅元素的质量分数为: ![]() ×
×![]() ;(5) 洗涤沉淀的方法:用胶头滴管向漏斗中加蒸馏水至没过沉淀,待水自然流完后,重复上述操作2-3次。
;(5) 洗涤沉淀的方法:用胶头滴管向漏斗中加蒸馏水至没过沉淀,待水自然流完后,重复上述操作2-3次。