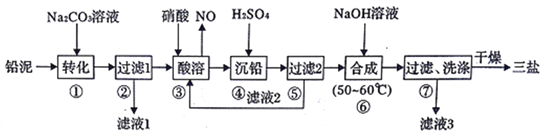
题目内容
【题目】X 、Y 、Z 、M 、N 、Q皆为1~20 号元素,其原子半径与主要化合价的关系如图所示。下列说法不正确的是( )

A. 1 mol 的QX2与足量X2Y 反应可产生2 md X2
B. 简单离子半径:Y 2—>N+>M 3+
C. 由X、Y、Z 三种元素形成的化合物只能是共价化合物
D. Z 、N 、M 的最高价氧化物的水化物两两间都能反应
【答案】C
【解析】X、Y、Z、M、N、Q皆为短周期主族元素,由图中化合价可知,X的化合价为+1和-1价,故X为H元素,Y的化合价为-2价,没有正化合价,故Y为O元素,Z的最高正价为+5价、最低价-3,则Z为N元素;Q的化合价为+2价,半径最大,应该为镁元素,N为+1价,原子半径小于镁,故N为Li元素;M的化合价为+3价,原子半径小于Li,故M为B元素。A、1 mol 的MgH2与足量H2O 反应可产生2 molH2,选项A正确;B、简单离子半径:O 2—>Li+>B3+,选项B正确;C、由H、O、N 三种元素形成的化合物NH4NO3是离子化合物,选项C不正确;D、 N 、Li 、Be 的最高价氧化物的水化物HNO3、LiOH、H3BO3两两间都能反应,选项D正确。答案选C。

【题目】某化学兴趣设计实验制取乙酸乙酯。现用下图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.

已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
请回答下列问题:
(1)该实验有机反应物中含有的官能团有__________(填写名称),若用同位素18O示踪法确定反应产物水分子中氧原子的提供者(设18O在CH3CH2OH中),写出能表示18O位置的化学方程式______________________________________, 反应类型是____________________。
(2)与书中采用的实验装置的不同之处是:这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中,在此处球形干燥管的作用除了使乙酸乙酯充分冷凝外还有____________________;加热一段时间后,可观察到烧杯D中液面________(填“上”或“下”)有无色油状液体生成,若分离该液体混合物,需要用到的玻璃仪器是____________________,这种方法叫做________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________________;再加入无水硫酸钠,然后进行蒸馏,收集产品乙酸乙酯时,温度应控制在________左右。
(4)乙酸可使紫色石蕊试液变红,说明乙酸具有____________________性,写出乙酸与碳酸钠溶液反应的离子方程式____________________________________________。
【题目】霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=_______________________,T1℃时,该反应的平衡常数K=____________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_______(填字母)。
a.升高温度 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30 min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q__________(填“>”、“=”或“<”)0。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
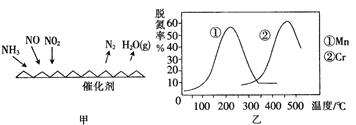
①由图甲可知,SCR技术中的氧化剂为_______________。已知c(NO2):c(NO)=1:1时脱氮效果最佳, 若生成1 mol N2时反应放出的热量为Q kJ。此时对应的脱氮反应的热化学方程式为__________________________
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应温度分别为___________________________。
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。已知常温下Ka1(H2SO3)=1.8×10-2 , Ka2(H2SO3)=6.0×10-9。常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=____________。
【题目】草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO2、MgO、CaO等]制取草酸钴晶体(CoC2O42H2O)工艺流程如图:
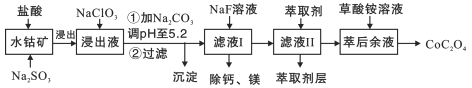
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的PH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的离子方程式为________________________
(2)NaClO3的作用是_________________调PH至5.2,沉淀的主要成分为__________
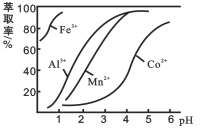
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示。滤液Ⅱ中加入萃取剂的作用是___________________;使用萃取剂适宜的pH是_______________
A. 接近2.0 B.接近3.0 C.接近5.0
(4)除钙、镁是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀,已知Ksp(MgF2)=7.35×1011、Ksp(CaF2)=1.05×1010.当加入过量NaF后,所得滤液c(Mg2+):c(Ca2+)=________________.
(5)已知含钴废料中含Co2O3质量分数为a%,若取mkg该含钴废料按照上述流程,理论上最多能制得草酸钴晶体的质量为_________________g