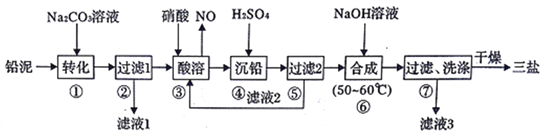
题目内容
【题目】锰锂电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
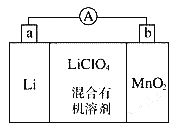
(1)外电路的电流方向是由____极流向___极(填字母)
(2)电池正极反应式___________。
(3)MnO2可与KOH和KClO3在高温下反应,生成反应的化学方程式为___________。
【答案】 b a MnO2+e-+Li+=LiMnO2 3MnO2+KClO3+6KOH=3K2MnO4+KCl+3H2O
【解析】(1)该电池中Li失去电子生成Li+,所以Li作电池的负极,则a是负极,b是正极,所以外电路中的电流方向由正极流向负极,所以从b流向a;
(2)正极发生还原反应,根据Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。则MnO2得电子与锂离子生成LiMnO2。电池反应式为MnO2+e-+Li+=LiMnO2;
(3)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,Mn元素的化合价升高,根据氧化还原反应规律,Cl元素的化合价降低,所以产物中有KCl生成,结合元素守恒,产物中还有谁生成,所以化学方程式为3MnO2+KClO3+6KOH=3K2MnO4+KCl+3H2O。

【题目】过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:

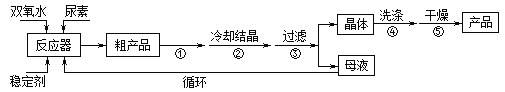
请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。
【题目】霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=_______________________,T1℃时,该反应的平衡常数K=____________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_______(填字母)。
a.升高温度 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30 min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q__________(填“>”、“=”或“<”)0。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
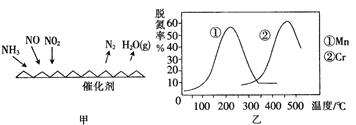
①由图甲可知,SCR技术中的氧化剂为_______________。已知c(NO2):c(NO)=1:1时脱氮效果最佳, 若生成1 mol N2时反应放出的热量为Q kJ。此时对应的脱氮反应的热化学方程式为__________________________
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应温度分别为___________________________。
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。已知常温下Ka1(H2SO3)=1.8×10-2 , Ka2(H2SO3)=6.0×10-9。常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=____________。