题目内容
【题目】下列有关物质分类的叙述正确的是
A.CaCl2、NaOH、HCl、O2四种物质都属于化合物
B.溶液、浊液、胶体都属于混合物
C.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
D.CO2、CO等非金属氧化物均属于酸性氧化物
【答案】B
【解析】
A.O2是单质,不是化合物,故A错误;
B.溶液、浊液、胶体都是由分散质和分散剂组成的,都属于混合物,故B正确;
C.硫酸是酸,纯碱是碳酸钠,属于盐,醋酸钠是盐,生石灰是金属氧化物,分别属于酸、盐、盐和氧化物,故C错误;
D.CO不能和碱反应,属于不成盐氧化物,CO2和碱反应生成盐和水,属于酸性氧化物,故D错误;
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】对分别盛有不同无色溶液①②③④四支试管进行如下操作。现象和结论对应正确的是
操作 | 现象 | 结论 | |
A | 向①中滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
B | 向②中滴入NaHCO3溶液 | 有白色沉淀生成 | 原溶液中有AlO2- |
C | 向③中先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
D | 向④中滴加氯水和CCl4,振荡静置 | 下层溶液呈橙色 | 原溶液中有I- |
A. A B. B C. C D. D
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4]生产铁红和补血剂乳酸亚铁。其生产步骤如下:
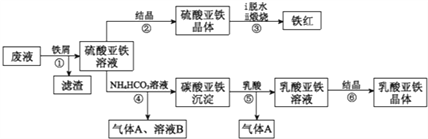
已知:TiOSO4可溶于水,在水中可以电离为TIO2+和SO42-,TiOSO4水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OHCOOH.请回答:
(1)步骤①中分离硫酸重铁溶液和滤渣的操作是______________。
(2)加入铁屑的目一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2·xH2O滤渣,用平衡移动的原理解释得到滤渣的原因_______________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_____________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因___________________。
(5)步骤④的离子方程式是________________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_______________。
(7)乳酸亚佚晶体{[CH3CH(OH)COO]2Fe·3H2O}纯度的测量:若用KMnO4滴定法测定样品中Fe的量进而计算纯度时,发现结果总是大于100%,其原因可能是_______________。
经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00mL,用0.1000mol/LCe(SO4)2标准溶液滴定至终点记录数据如下表。
滴定次数 | 0.1000mol/LCe(SO4)2标准溶液/mL | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 19.85 |
2 | 0.12 | 21.32 |
3 | 1.05 | 20.70 |
4 | 0.16 | 19.88 |
则产品中乳酸亚铁晶体的纯度为_______(以质量分数表示)。
【题目】下列关于纯净物、混合物、强电解质、弱电解质和非电解质的组合正确的是
组合 | 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
A | 氨水 | 食盐水 | 硫酸 | 醋酸 | 干冰 |
B | 氧化铁 | 家用食醋 | 硫酸钡 | 碳酸 | 蔗糖 |
C | 胆矾 | 碘酒 | 苛性钠 | 碳酸 | 碳酸钙 |
D | 盐酸 | 氯化钾溶液 | 氯化钠 | 氢氧化铜 | 氢气 |
A.AB.BC.CD.D