题目内容
【题目】(1)积极保护生态环境可实现人与自然的和谐共处。
①下列做法会加剧温室效应的是__________(填字母)。
a.植树造林 b.燃煤供暖 c.风力发电
②下列防治“白色污染”的正确方法是_____________(填字母)。
a.使用可降解塑料 b.露天焚烧废旧塑料 c.直接填埋废旧塑料
③为减轻大气污染,多个城市已禁止燃放烟花爆竹。“禁止燃放烟花爆竹”的标识是_____(填字母)。

(2)合理使用化学知识可提高人们的生活质量。
某品牌牙膏的成分有甘油、山梨酸钾、氟化钠等。
①在上述牙膏成分中,属于防腐剂的是_______________。
②甘油的结构简式为____________;油脂水解可生成甘油和_____________。
③氟化钠(NaF)可与牙齿中的羟基磷酸钙[Ca5(PO4)3OH]反应,生成更难溶的氟磷酸钙[Ca5(PO4)3F],从而达到防治龋齿的目的。写出该反应的化学方程式:____________________。
(3)创新发展材料技术科推动人类社会的进步。
①石墨烯(见下图)可用作太阳能电池的电极,这里主要利用了石墨烯的______________性。

②基础工程建设中常用到水泥、玻璃、钢材等。生成水泥和玻璃都用到的原料是__________;在钢材中添加铬、镍等元素的目的是___________。
③新型战斗机常用纳米SiC粉体作为吸波材料。高温下焦炭和石英反应可制得SiC,石英的化学式为________________;高温分解Si(CH3)2Cl2也可制得SiC,同时还生成CH4和一种常见酸性气体,写出该反应的化学方程式:____________________________________。
【答案】 b a c 山梨酸钾 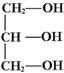 高级脂肪酸(或高级脂肪酸盐) Ca5(PO4)3OH + NaF=Ca5(PO4)3F + NaOH 导电 石灰石 增强钢材的抗腐蚀能力 SiO2 Si(CH3)2Cl2 高温 SiC+CH4↑+2HCl↑
高级脂肪酸(或高级脂肪酸盐) Ca5(PO4)3OH + NaF=Ca5(PO4)3F + NaOH 导电 石灰石 增强钢材的抗腐蚀能力 SiO2 Si(CH3)2Cl2 高温 SiC+CH4↑+2HCl↑
【解析】(1)①a.大力植树造林能够控制二氧化碳的含量升高,有利于减缓温室效应.故a正确;b.燃煤供暖,可能够排放更多的二氧化碳,会加剧温室效应,故b错误;c.风力发电,可减少二氧化碳的排放,有利于减缓温室效应.故c正确;答案为b;
②a.降解塑料的使用可减少白色污染,故a正确;b.露天焚烧废旧塑料,会造成环境污染,故b错误;c.直接填埋废旧塑料,无法从根本上直接消除白色污染,故c错误;答案为a;
③ 是禁止吸烟标志,故a错误;
是禁止吸烟标志,故a错误; 是禁止明火标志,故b错误;
是禁止明火标志,故b错误; 是禁止禁止燃放烟花爆竹标志,故c正确;答案为c;
是禁止禁止燃放烟花爆竹标志,故c正确;答案为c;
(2)①在上述牙膏成分中,山梨酸钾属于防腐剂;
②丙三醇俗称甘油,其结构简式为![]() ;油脂是高级脂肪酸的甘油脂,其水解可生成甘油和高级脂肪酸;
;油脂是高级脂肪酸的甘油脂,其水解可生成甘油和高级脂肪酸;
③氟化钠(NaF)与羟基磷酸钙[Ca5(PO4)3OH]反应,生成更难溶的氟磷酸钙[Ca5(PO4)3F]的化学方程式为Ca5(PO4)3OH + NaF=Ca5(PO4)3F + NaOH;
(3)①电池的电极应该是导体,则石墨烯用作太阳能电池的电极,是利用石墨烯的导电性;
②生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥;所以在玻璃工业、水泥工业中都用到的原料是石灰石;为增强钢材的抗腐蚀能力,通常在钢材中添加铬、镍等;
③石英的主要成分是二氧化硅,其化学式为SiO2;高温分解Si(CH3)2Cl2也可制得SiC,同时还生成CH4和一种常见酸性气体HCl,该反应的化学方程式为Si(CH3)2Cl2 ![]() SiC+CH4↑+2HCl↑。
SiC+CH4↑+2HCl↑。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
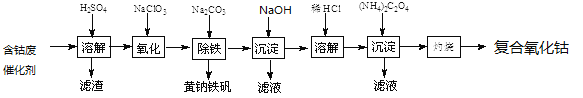
(1)用H2SO4溶解后过滤,得到的滤渣是_________(填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是____________________。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是___________________。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是__________________。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式:_______________________。
(5)弱酸和弱碱的电离平衡常数的负对数可用pK表示,根据下表中数据判断(NH4)2C2O4溶液中各离子的浓度由大到小的顺序为__________________。
H2C2O4 | pKa1= l.25,pKa2=4.13 |
NH3·H2O | pKb=4.76 |
(6)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤其原因是_____________________。
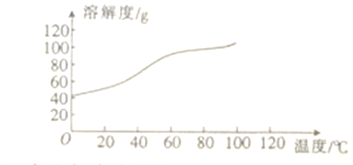
(7)准确称取1.470gCoC2O4,在空气中充分灼烧得0.814g复合氧化钴,写出复合氧化钴的化学式:_________________________。