题目内容
铁氧体是一类磁性材料,通式为MO· xFe2O3(M为二价金属离子)。
根据题意完成:
(1)为了制备铁氧体,称取5.6g铁粉、一定量的FeCl3(s) 作为原料,先制备Fe3O4。方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4 [ 已知1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4 ]。需要加入FeCl3(s) g。
(2)如果以MgSO4(s)和FeCl3(s)为原料制备9.0 g MgO· 2Fe2O3,在制取过程中至少需要1 mol/L的NaOH(aq)
mL。
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取a克该产品溶于100mL盐酸(足量)中,需要通入672 mL(标准状况)Cl2才能把溶液中的Fe2+ 全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6 g固体。计算:
①ag 该产品溶于盐酸后,溶液中Fe2+ 的物质的量浓度(溶液体积变化忽略不计)。
②推算该产品的化学式(写出推算过程)。
(4)有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+ · Fe3+[ Fe3+(1-x) · Cr3+x · O4]。向含有1.92 mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688 L(标准状况)。计算:(均需写出计算过程)
①参加反应的铁氧体的物质的量。
②所得气体中NO、NO2的体积比。
(1)32.5 g(3分)
(2)350mL(2分,1分)
(3)①0.6 mol/L(1分×2) ②2FeO · Fe2O3(1分×3)
(4)①0.2 mol(1分×2) ②V(NO):V(NO2)=1:2(1分×3)
解析试题分析:(1)按题中所给,1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4其中,Fe(OH)2来自铁粉,Fe(OH)3来自FeCl3。为达到1:2的关系,需要氯化铁0.2mol,质量 32.5g。
(2) 9.0g的MgO 2Fe2O3 共0.025mol,其中有0.025molMg2+、0.1molFe3+,需要NaOH 0.35mol ,即题中溶液350ml;
(3)①氯气的物质的量为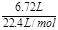 =0.03mol,氯气氧化Fe2+为Fe3+,根据电子转移守恒可知Fe2+的物质的量为
=0.03mol,氯气氧化Fe2+为Fe3+,根据电子转移守恒可知Fe2+的物质的量为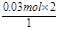 =0.06mol,故氧化物中+2价铁的物质的量为0.06mol,溶液中Fe2+ 的物质的量浓度0.6 mol/L;②最后所得为氯化铁溶液,蒸干溶液,灼烧至恒重,得9.6g固体为Fe2O3,Fe2O3的物质的量为
=0.06mol,故氧化物中+2价铁的物质的量为0.06mol,溶液中Fe2+ 的物质的量浓度0.6 mol/L;②最后所得为氯化铁溶液,蒸干溶液,灼烧至恒重,得9.6g固体为Fe2O3,Fe2O3的物质的量为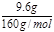 =0.06mol,利用铁元素守恒可知氧化物中+3价铁的物质的量为0.06mol×2-0.06mol=0.06mol,故FeO与Fe2O3的物质的量之比为0.06mol:
=0.06mol,利用铁元素守恒可知氧化物中+3价铁的物质的量为0.06mol×2-0.06mol=0.06mol,故FeO与Fe2O3的物质的量之比为0.06mol: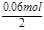 =2:1,该产品化学式为2FeO?Fe2O3,故答案为:2FeO?Fe2O3;(4)①根据题目的分子式,那其中的X只能取1,其他情况皆不符合,一个分子中不可能有半个铬离子,然后就可以得到分子式了,为Fe2+Fe3+[ Cr3+· O4]。,可以看出,分子式中的铁元素数目为铬元素数目的2倍。然后,根据溶液电荷守恒定律,有3n(Fe3+)+3n(Cr3+)=n(NO3-),根据氮元素守恒,拿硝酸的量减去溢出气体的量2.688/22.4即为溶液中氮元素的量,也即1.92-0.12=1.8mol,为溶液中硝酸跟的浓度,那么根据电荷守恒式和n(Fe3+)=2(Cr3+),可以得到n(Cr3+)=0.2mol。一个铬铁氧体分子中分子中只有一个铬原子,他俩是一比一关系,那么消耗铬铁氧体的量就是0.2mol。
=2:1,该产品化学式为2FeO?Fe2O3,故答案为:2FeO?Fe2O3;(4)①根据题目的分子式,那其中的X只能取1,其他情况皆不符合,一个分子中不可能有半个铬离子,然后就可以得到分子式了,为Fe2+Fe3+[ Cr3+· O4]。,可以看出,分子式中的铁元素数目为铬元素数目的2倍。然后,根据溶液电荷守恒定律,有3n(Fe3+)+3n(Cr3+)=n(NO3-),根据氮元素守恒,拿硝酸的量减去溢出气体的量2.688/22.4即为溶液中氮元素的量,也即1.92-0.12=1.8mol,为溶液中硝酸跟的浓度,那么根据电荷守恒式和n(Fe3+)=2(Cr3+),可以得到n(Cr3+)=0.2mol。一个铬铁氧体分子中分子中只有一个铬原子,他俩是一比一关系,那么消耗铬铁氧体的量就是0.2mol。
②这题的可以利用氧化还原知识来解,因为生成NO、NO2的反应为二价铁离子和硝酸的反应,分别写出两个反应的离子反应方程式,然后设生成NO为Xmol,NO2为ymol,根据生成气体总量,可知x+y=2.688/22.4=0.12,然后根据反应式的对应关系,根据二价铁(等于消耗铬铁氧体的量)的含量为3x+y=0.2,联立方程解出得x = 0.04 y = 0.08,则x:y-1:2,V(NO):V(NO2)=1:2。
考点:本题以铁氧体磁性材料制备为载体,考查混合物的有关计算,难度中等,注意根据元素守恒与极限法进行解答。

一定质量的某铁的氧化物FexOy,与足量4 mol/L稀硝酸溶液充分反应,消耗硝酸700mL,放出2.24LNO气体(标准状况)。则该铁的氧化物的化学式为
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.Fe8O10 |
有关物质结构的表述错误的是
| A.氯乙烯的结构简式:CH2="CHCl" |
B.氮分子的结构式: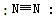 |
| C.氨分子的空间构型:三角锥形 |
| D.氯离子的最外层电子排布式:3s23p6 |
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。 据此下列说法错误的是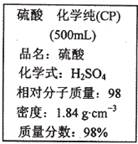
| A.该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 |
| B.取10 mL该硫酸于烧杯中,再加等体积的水,可配得49%的硫酸 |
| C.配制200mL4.6 mol·L-1的稀硫酸需取该硫酸50 mL |
| D.该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol·L-1 |
0.001mol金属放入10mL0.1mol/L某酸溶液中,产生22.4mL氢气(标准状况),下列情况中一定不可能的是
| A.一价金属和一元酸 | B.二价金属和二元酸 |
| C.三价金属和二元酸 | D.二价金属和一元酸 |
下列化学用语不正确的是
A.二氧化碳的电子式是: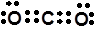 |
B.铝离子的结构示意图是: 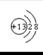 |
C. 的中子数与质子数之差是2 的中子数与质子数之差是2 |
| D.Na2O2中的阳离子数与阴离子数之比为1:1 |
以色列科学家Daniel Shechtman因发现准晶体获得2011年诺贝尔化学奖。人们在自然界中也找到了组成为Al63Cu24Fe13的天然准晶体。将相同质量的此准晶体分别与足量的盐酸、烧碱和稀硝酸反应,产生气体的物质的量关系为
| A.n(烧碱)<n(稀硝酸)<n(盐酸) | B.n(烧碱)<n(盐酸)<n(稀硝酸) |
| C.n(稀硝酸)<n(烧碱)<n(盐酸) | D.n(盐酸)<n(稀硝酸)<n(烧碱) |
下列说法中正确的是
A.氯化钠的电子式是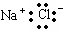 |
| B.按照不同分类标准,KAl(SO4)2属于强电解质、硫酸盐、酸式盐 |
| C.标准状况下,2.24 L C2H6中含有0.6 NA对共用电子对 |
| D.Mg、F2、H2O2依次是只有还原性、只有氧化性、既有氧化性也有还原性 |
NA力阿伏加德罗常数,下列叙述正确的是
| A.1mol苯含有的C=C键数为3NA |
| B.1mol Na2O2与水完全反应时转移的电子数为NA |
| C.含NA个Na+的Na2O溶解于1L水中,Na+浓度为1mol·L-1 |
| D.1mol O2和2mol SO2在密闭容器中充分反应后的分子数等于2NA |