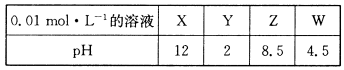
题目内容
(1)室温下在pH=12的NaCN溶液中,由水电离的c(OH—)为 mol?L—1。
(2)浓度为0.1mol?L—1的下列各物质的溶液中,c(NH4+)由大到小的顺序是___(填序号)。
①NH4Cl ②NH4HSO4 ③NH3?H2O ④CH3COONH4
(3)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H+ +HA—,HAˉ H+ +A2—。
H+ +A2—。
①则Na2A溶液显____性;NaHA溶液显 性(填“酸性”、“中性”或“碱性”)。
②若有0.1mo1?L—1Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
(4)在含有Cl—、Br—、I—的溶液中,已知其浓度均为0.1mo1/L,已知AgCl、AgBr、AgI的溶度积分别为1.6×10—10、4.l×10—15、1.5×10—16,若向混合溶液中逐滴加入AgNO3溶液,试回答:
①当AgBr沉淀开始析出时,溶液中Ag+浓度是 。
②当AgC1沉淀开始析出时,溶液中的Br—、I—是否完全沉淀 (当溶液中离子浓度小于1.0×10—5mo1/L时,认为已经沉淀完全,本空选填“是”或“否”)。
(2)浓度为0.1mol?L—1的下列各物质的溶液中,c(NH4+)由大到小的顺序是___(填序号)。
①NH4Cl ②NH4HSO4 ③NH3?H2O ④CH3COONH4
(3)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H+ +HA—,HAˉ
 H+ +A2—。
H+ +A2—。①则Na2A溶液显____性;NaHA溶液显 性(填“酸性”、“中性”或“碱性”)。
②若有0.1mo1?L—1Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
| A.c(Na+)>c(A2—)>c(OH—)>c(HA—)>c(H+) |
| B.c(Na+)> c(OH—)>c(HA—)> >c(A2—) > c(H+) |
| C.c(Na+)> c(H+)> c(A2—)> c(OH—)>c(HA—) |
| D.c(A2—)>c(Na+)> c(OH—) > c(H+)>c(HA—) |
①当AgBr沉淀开始析出时,溶液中Ag+浓度是 。
②当AgC1沉淀开始析出时,溶液中的Br—、I—是否完全沉淀 (当溶液中离子浓度小于1.0×10—5mo1/L时,认为已经沉淀完全,本空选填“是”或“否”)。
(1)10—2(1分)
(2)②>①>④>③(2分)
(3)①碱性(1分) 酸性(1分)②A(2分)
(4)①4.1×10—14mo1/L(2分) ②是(1分)
(2)②>①>④>③(2分)
(3)①碱性(1分) 酸性(1分)②A(2分)
(4)①4.1×10—14mo1/L(2分) ②是(1分)
试题分析:(1)NaCN是强碱弱酸盐,则水电离的c(OH—)=c(OH—)=
 =10—2mol/L;(2)NH3?H2O的电离程度最小,则其所含c(NH4+)最小;HSO4—或H+能抑制NH4+的水解,则NH4HSO4溶液中c(NH4+)最大;CH3COO—能促进NH4+的水解,则CH3COONH4溶液中c(NH4+)比NH4Cl溶液小;(3)由于A2—+H2O
=10—2mol/L;(2)NH3?H2O的电离程度最小,则其所含c(NH4+)最小;HSO4—或H+能抑制NH4+的水解,则NH4HSO4溶液中c(NH4+)最大;CH3COO—能促进NH4+的水解,则CH3COONH4溶液中c(NH4+)比NH4Cl溶液小;(3)由于A2—+H2O HAˉ+OHˉ,则Na2A溶液显碱性;由于HAˉ
HAˉ+OHˉ,则Na2A溶液显碱性;由于HAˉ H+ +A2—,则NaHA溶液显酸性;Na2A=2Na++A2—,A2—+H2O
H+ +A2—,则NaHA溶液显酸性;Na2A=2Na++A2—,A2—+H2O HAˉ+OHˉ,H2O
HAˉ+OHˉ,H2O H+ +OH—,由电离、水解原理可知,c(Na+)>c(A2—)>c(OH—)>c(HA—)>c(H+),故选A;(4)由于c(Ag+)?c(Br—)=Ksp(AgBr),则c(Ag+)=
H+ +OH—,由电离、水解原理可知,c(Na+)>c(A2—)>c(OH—)>c(HA—)>c(H+),故选A;(4)由于c(Ag+)?c(Br—)=Ksp(AgBr),则c(Ag+)= =4.1×10—14mo1/L;c(Ag+)?c(Cl—)=Ksp(AgCl),则c(Ag+)=
=4.1×10—14mo1/L;c(Ag+)?c(Cl—)=Ksp(AgCl),则c(Ag+)=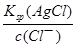 =1.6×10—9mo1/L,此时Qc(AgI)=c(Ag+)?c(I—)=1.6×10—10>Ksp(AgI),Qc(AgBr)=c(Ag+)?c(Br—)=1.6×10—10>Ksp(AgBr),则Br—、I—已经沉淀完全。
=1.6×10—9mo1/L,此时Qc(AgI)=c(Ag+)?c(I—)=1.6×10—10>Ksp(AgI),Qc(AgBr)=c(Ag+)?c(Br—)=1.6×10—10>Ksp(AgBr),则Br—、I—已经沉淀完全。
练习册系列答案
相关题目