题目内容
X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.0 1 mol·L-1的X、Y、Z、W溶液的pH。
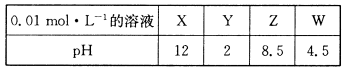
(1)X、W的化学式分别为_______、________。
(2)W的电离方程式为______________________________。
(3)25℃时,Z溶液的pH>7的原因是______________________________________(用离子方程式表示)。
(4)将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 _______________________________________________________ 。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为__________________________________________________________。

(1)X、W的化学式分别为_______、________。
(2)W的电离方程式为______________________________。
(3)25℃时,Z溶液的pH>7的原因是______________________________________(用离子方程式表示)。
(4)将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 _______________________________________________________ 。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为__________________________________________________________。
(1)NaOH;NH4NO3(2)NH4NO3=NH4++NO3-(3)NO2-+H2O HNO2+OH-
HNO2+OH-
(4)c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+)
(5)NaNO2+NH4NO3 NaNO3+N2↑+2H2O
NaNO3+N2↑+2H2O
 HNO2+OH-
HNO2+OH-(4)c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+)
(5)NaNO2+NH4NO3
 NaNO3+N2↑+2H2O
NaNO3+N2↑+2H2O试题分析:(1)HNO3是强酸,0.01mol·L-1 HNO3溶液的pH为2,NH4NO3是强酸弱碱盐,NH4+不完全水解生成H+溶液显酸性pH小于7,NaOH为强碱,0.01mol·L-1NaOH溶液的pH为12,NaNO2是强碱弱酸盐溶液,NO2—在溶液中水解显碱性pH大于7,故X为NaOH,Y为HNO3,Z为NaNO2,W为 NH4NO3(2)NH4NO3在溶液中完全电离生成NH4+与NO3-,电离方程式:NH4NO3=NH4++NO3-(3)NO2-在溶液中水解生成HNO2与OH-,使溶液显碱性,离子方程式NO2-+H2O
 HNO2+OH-(4)由题意知,混合溶液中各离子的浓度大小顺序即为物质的量大小顺序,设每种溶液各1L,则在Na+溶液中完全电离物质的量为2mol,NO3-在溶液中完全电离物质的量为1mol,NaOH中OH-与HNO3中H+等物质的量完全反应,NO2-在溶液中部分水解产生OH-,混合溶液中H+由水电离,故浓度大小顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+)(5)NaNO2溶液与NH4NO3溶液混合加热,产生一种无色无味的单质气体只可能为N2反应方程式:NaNO2+NH4NO3
HNO2+OH-(4)由题意知,混合溶液中各离子的浓度大小顺序即为物质的量大小顺序,设每种溶液各1L,则在Na+溶液中完全电离物质的量为2mol,NO3-在溶液中完全电离物质的量为1mol,NaOH中OH-与HNO3中H+等物质的量完全反应,NO2-在溶液中部分水解产生OH-,混合溶液中H+由水电离,故浓度大小顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+)(5)NaNO2溶液与NH4NO3溶液混合加热,产生一种无色无味的单质气体只可能为N2反应方程式:NaNO2+NH4NO3 NaNO3+N2↑+2H2O
NaNO3+N2↑+2H2O
练习册系列答案
相关题目
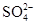
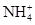 、Ba2+、
、Ba2+、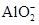 、Cl-
、Cl-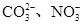
 H+ +A2—。
H+ +A2—。