题目内容
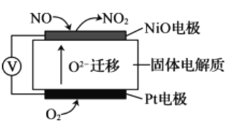
【题目】室温下,用0.10mol/L的氢氧化钠溶液滴定10.00mL0.10mol/L醋酸溶液,水的电离度随氢氧化钠溶液体积的变化曲线如图所示,下列说法正确的是( )

A.该滴定过程应该选择甲基橙作为指示剂
B.N点溶液中c(OH-)=c(CH3COO-)+c(CH3COOH)+c(H+)
C.从P点到N点,溶液中水的电离程度逐渐增大
D.M点对应的NaOH溶液的体积为10.00mL
【答案】D
【解析】
A. CH3COOH与NaOH恰好反应时生成强碱弱酸盐醋酸钠,溶液呈碱性,而甲基橙的变色范围为3.1-4.4,应该选用酚酞作为滴定指示剂,故A错误;
B. N点溶液中溶质为等浓度的NaOH和醋酸钠,根据电荷守恒可得:c(H+)+c(Na+)=c( CH3COO)+c(OH),有物料守恒可得:c(Na+)=2c(CH3COO)+2 c(CH3COOH),把钠离子消去可得:c(OH-)=c(CH3COO-)+2c(CH3COOH)+c(H+),故B错误;
C. 根据图象曲线变化可知,溶液中水的电离程度逐渐增大,恰好反应时达到最大,之后又开始减小,故C错误;
D. M点水的电离程度最大,说明此时溶质为醋酸钠,醋酸与氢氧化钠恰好反应,则对应的NaOH溶液的体积为10.00mL,故D正确;
故选:D。

【题目】某研究小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略)
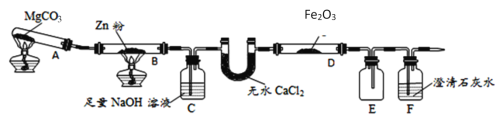
(1)图中盛无水CaCl2的仪器名称为______装置B中的化学反应方程式为_______。
(2)装置C中发生反应的离子方程式为_________,处理尾气的方法为________。
(3)将研究小组分为两组,按上图装置进行对比实验,探究不同温度条件下黑色固体的成分,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 取步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末成分是________。
②根据甲组实验现象写出甲组步骤1中反应的离子方式__________。
③乙组步骤4中,溶液变红的原因为________,溶液褪色可能的原因________及其验证方法为________。
【题目】(1)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。

参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中分子间存在的两种作用力是_____________________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是_____。
(2) H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为____________。