题目内容
13.已知有机物B的分子式是C2H6O,C是一种可用作果实催熟的气体.试根据以下各类变化(见下图)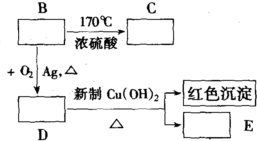
(1)写出B、C、D、E的结构简式.
(2)写出化学方程式.
B→CCH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
分析 有机物B的分子式是C2H6O,C是一种可用作果实催熟的气体,根据B生成C的反应条件可知,C为CH2=CH2,B为CH3CH2OH,乙醇发生催化氧化生成D为CH3CHO,乙醛进一步发生氧化反应生成E为CH3COOH,据此解答.
解答 解:有机物B的分子式是C2H6O,C是一种可用作果实催熟的气体,根据B生成C的反应条件可知,C为CH2=CH2,B为CH3CH2OH,乙醇发生催化氧化生成D为CH3CHO,乙醛进一步发生氧化反应生成E为CH3COOH,
(1)根据上面的分析可知,B为CH3CH2OH,C为CH2=CH2,D为CH3CHO,E为CH3COOH,
故答案为:CH3CH2OH;CH2=CH2;CH3CHO;CH3COOH;
(2)B→C的化学方程式为CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
点评 本题考查有机物推断,涉及烯烃、醇、醛的性质与转化,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
3.H2在O2中燃烧生成H2O的反应是放热反应,则( )
| A. | 该过程中热能转化为化学能 | |
| B. | 反应物的总能量小于生成物的总能量 | |
| C. | 该过程中化学能转化为电能 | |
| D. | 反应物的总能量大于生成物的总能量 |
4.下列反应中硫酸既表现出了强氧化性又表现了酸性的是( )
| A. | 氧化铜与硫酸反应 | B. | 氢氧化铝与硫酸反应 | ||
| C. | 木炭粉与浓硫酸反应 | D. | 铜与浓硫酸反应 |
1.已知:CH3(CH2)2CH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l);△H=-2878kJ•mol-1
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l);△H=-2869kJ•mol-1
下列说法正确的是( )
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l);△H=-2869kJ•mol-1
下列说法正确的是( )
| A. | 正丁烷的燃烧热为-2878kJ•mol-1 | |
| B. | 正丁烷分子所具有的能量大于异丁烷分子 | |
| C. | 等量的异丁烷分子中碳氢键比正丁烷的多 | |
| D. | 异丁烷转化为正丁烷的过程是一个放热过程 |
8.下列能用分液漏斗分离的混合物是( )
| A. | 液溴和四氯化碳 | B. | 乙酸和乙醇 | ||
| C. | 乙酸乙酯和蒸馏水 | D. | 溴苯和苯 |
18.已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
830℃时,向一个5L的密闭容器中充入0.2mol的A和0.8mol的B,下列说法不正确的是( )
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 该反应的△H<0 | |
| B. | 若反应经过一段时间后,达到平衡时A的转化率为80% | |
| C. | 如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1.则6s时 n(A)为0.11 mol | |
| D. | c(A)不随时间改变或单位时间里生成c和D的物质的量相等均可作为是否达到平衡的依据 |
5.某有机物的结构简式为 ,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )
,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )
 ,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )
,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )| A. | 5mol | B. | 4mol | C. | 3mol | D. | 2mol |
17.与CH3CH2CH=CH2互为同分异构体的是( )
| A. |  | B. | CH2=CH-CH=CH2 | C. | 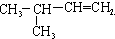 | D. | 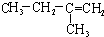 |
18.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17.下列关于不溶物之间转化的说法中错误的是( )
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{8.5}{\sqrt{1.8}}$×10-12mol•L-1 |