题目内容
15.某同学进行如下实验,探究化学反应中的能量变化.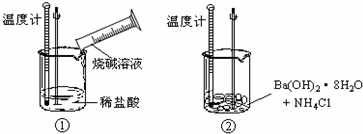
通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低.由此判断Ba(OH)2•8H2O跟NH4Cl的反应是吸热(填“吸热”或“放热”)反应.试写出①中反应的离子方程式:H++OH-=H2O.
分析 探究化学反应中的能量变化时,温度升高,则反应放热,温度降低、反应吸热,根据化学方程式书写离子方程式.
解答 解:通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低,根据温度升高,反应放热,温度降低、反应吸热,所以NaOH溶液跟盐酸的反应是放热反应,Ba(OH)2•8H2O跟NH4Cl的反应是吸热反应,NaOH溶液跟盐酸反应方程式为:HCl+NaOH=NaCl+H2O,实质是:H++OH-=H2O.
故答案为:吸热;H++OH-=H2O.
点评 本题考查学生根据实验现象判断放热与吸热反应,难度不大,侧重于基础知识的考查,注意把握实验原理.

练习册系列答案
相关题目
5.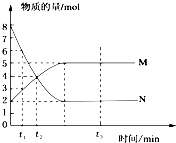 在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )
在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )
 在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )
在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )| A. | 0~t2内用M表示的平均反应速率是 $\frac{2}{{t}_{2}}$(mol•L-1•min-1) | |
| B. | t1~t2内容器内的压强逐渐减小 | |
| C. | 该反应的方程式为N?2M | |
| D. | t2与t3时刻的混合气体的平均相对分子质量相等 |
6.下列说法不正确的是( )
①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎完全相同
③元素种类由质子数决定,原子种类由质子数和中子数共同决定,元素主要化学性质由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素.
①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎完全相同
③元素种类由质子数决定,原子种类由质子数和中子数共同决定,元素主要化学性质由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素.
| A. | ①②④⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ①⑤ |
3.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g | |
| D. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
10.下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A. | 它们的原子核外电子层数随核电荷数的增加而增多 | |
| B. | 它们的熔沸点随核电荷数的增加而增加 | |
| C. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| D. | 单质的颜色随核电荷数的增加而加深 |
20.下列电子式中,书写正确的是( )
| A. | 过氧化钠 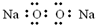 | B. | 氟化氢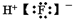 | C. | 氮气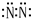 | D. | 氯化镁 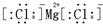 |
7.海带中富含碘元素,有人设计如下步骤来提取碘:①通足量氯气;②将海带烧成灰,向灰中加水搅拌:③加入CCl4振荡;④过滤;⑤用分液漏斗分液.合理的操作顺序为( )
| A. | ②一①一④一③一⑤ | B. | ②一④一①一③一⑤ | C. | ①一③一⑤一②一④ | D. | ③一①一②一⑤一④ |
4.下述实验设计合理的是( )
| A. | 用锌粒和稀硝酸反应制备H2 | B. | 用NH4NO3加热制取NH3 | ||
| C. | 大理石与稀硫酸反应制备CO2 | D. | 用焰色反应鉴别固体NaCl和 KCl |
18.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示.下列叙述正确的是( )

| A. | 迷迭香酸与溴单质只能发生取代反应 | |
| B. | 1 mol迷迭香酸最多能和8mol氢气发生加成反应 | |
| C. | 迷迭香酸不能发生取代反应和消去反应 | |
| D. | 1 mol迷迭香酸最多能与6 mol NaOH发生反应 |