题目内容
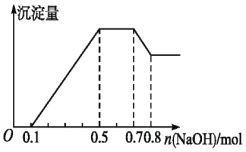
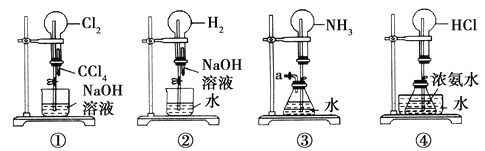
【题目】某同学进行了如图所示的实验,由实验现象得到的结论中正确的是
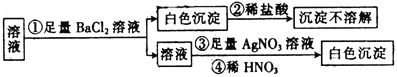
A.原溶液中一定只含有SO![]()
B.原溶液中一定含有SO![]() 和Cl-
和Cl-
C.原溶液中一定只含有Cl-
D.原溶液中可能含有SO![]() ,也可能含有Cl-
,也可能含有Cl-
【答案】D
【解析】
溶液中加入氯化钡溶液,产生了白色沉淀,白色沉淀不溶于稀盐酸,则白色沉淀可能为硫酸钡、氯化银,原溶液中可能存在SO42-或Ag+;由于①中加入了氯化钡,引进了氯离子,所以无法确定原溶液中是否含有氯离子,据此进行判断。
能够与氯化钡反应生成不溶于稀盐酸的沉淀的离子有SO42-或Ag+,由于步骤①中加入氯化钡溶液,引进了Cl-,步骤③也无法确定是否存在氯离子,所以无法确定原溶液中一定存在氯离子,原溶液中可能存在SO42-或Ag+,故选:D。

【题目】某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验③发生的反应的离子方程式为_____________________________。
(2)上述实验说明黑色粉末X中含有_______________________________。
II.定量测定
根据下图所示的实验方案进行实验并记录数据:
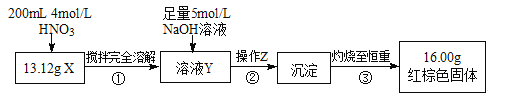
(1)操作Z的名称是_________。
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为_________。
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=________mol/L。