题目内容
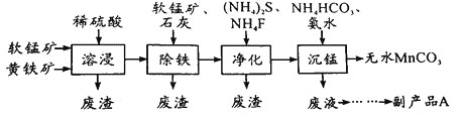
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有__________________(写一条)。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是______________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 molL-1,滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕,
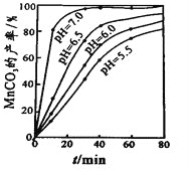
(4)沉锰工序中,298K、c(Mn2+)为1.05 molL-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是______________。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是______________________。
(6)从沉锰工序中得到纯净MnCO3的操作方法是___________________。副产品A的化学式是________。
【答案】 搅拌、适当升高温度、研磨矿石、适当提高稀硫酸的浓度 使残余的Fe2+转化为Fe3+ 1.46×10-6molL-1 pH等于7.0时反应速率最快,且MnCO3的产率最高 Mn2++2HCO3-= MnCO3↓+CO2↑+H2O 过滤、洗涤、干燥 (NH4)2SO4
【解析】本题分析:本题主要考查对于“制备高性能磁性材料碳酸锰(MnCO3)的工业流程”的评价。
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有搅拌、适当升高温度、研磨矿石、适当提高稀硫酸的浓度等。
(2) Fe3+比Fe2+容易转化为沉淀,所以加入适量的软锰矿,其作用是使残余的Fe2+转化为Fe3+。
(3) Ksp(CaF2)=c(Ca2+)c2(F-)=1.46×10-10,将c(F-)=0.01 molL-1代入,可得c(Ca2+)=1.46×10-6molL-1。
(4)根据图中信息得出的结论是pH等于7.0时反应速率最快,且MnCO3的产率最高。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是Mn2++2HCO3-= MnCO3↓+CO2↑+H2O。
(6)从沉锰工序中得到纯净MnCO3的操作方法是过滤、洗涤、干燥。副产品A的化学式是(NH4)2SO4。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验③发生的反应的离子方程式为_____________________________。
(2)上述实验说明黑色粉末X中含有_______________________________。
II.定量测定
根据下图所示的实验方案进行实验并记录数据:
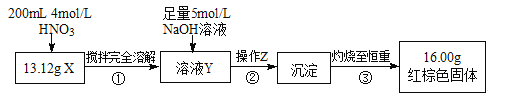
(1)操作Z的名称是_________。
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为_________。
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=________mol/L。
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是( )
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A.实验①反应后的溶液中:c(A﹣)>c(K+)>c(OH﹣)>c(H+)
B.实验①反应后的溶液中:c(OH﹣)=c(K+)﹣c(A﹣)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A﹣)+c(HA)<0.1 mol/L
D.实验②反应后的溶液中:c(K+)+c(OH﹣)=c(H+)+c(A﹣)