题目内容
【题目】利用反应6NO2+8NH3=7N2+12H2O设计的电池装置如图所示,该装置既能有效消除氮氧化物的排放减轻环境污染,又能充分利用化学能。下列说法正确的是
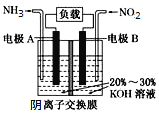
A.电极A上发生氧化反应,电极A为正极
B.电池工作时,OH—从右向左迁移
C.当有0.1molNO2被处理时,外电路中通过电子0.4mol
D.电极B的电极反应式为2NO2+8e—+8H+=N2+4H2O
【答案】BC
【解析】
根据总方程式6NO2+8NH3=7N2+12H2O中NO2可知,NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由-3价变为0价,所以NO2发生还原反应、NH3发生氧化反应,则通入NH3的A电极作负极、B电极作正极,负极电极方程式为2NH3-6e-+6OH-=N2+6H2O,正极反应式为2NO2+8e-+4H2O=8OH-+N2,电池工作时,电子从负极沿导线流向正极,内电路中阳离子移向正极,阴离子移向负极,据此分析解答。
由反应6NO2+8NH3=7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极;
A. A为负极,发生氧化反应,故A错误;
B. A为负极,B为正极,电池工作时,OH从右向左迁移,故B正确;
C. 当有0.1mol NO2被处理时,N元素从+4价降为0价,则外电路中通过电子0.4mol,故C正确;
D. 电极B为正极,发生还原反应,电极反应式为2NO2+8e-+4H2O=N2+8OH-,故D错误;
故答案选:BC。

【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握______________的活塞,右手摇动___________,眼睛注视________________,直到加入最后一滴盐酸时,溶液由______色变为______色,并_____________________为止。
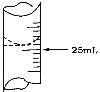
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为____________。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000 mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________(小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高_________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。