题目内容
【题目】在某一容积为2L的恒容密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化曲线如图所示。回答下列问题:
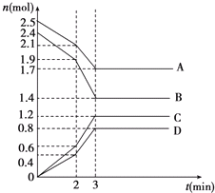
(1)该反应的化学方程式为______。
(2)前2min内用A的浓度变化表示的化学反应速率为_______, 4min时,v正(A)______v逆(D) (填“>”“<”或“=”)。
(3)在2min时,图象发生改变的原因可能是_____(填字母)
A 增大B的物质的量 B 降低温度
C 加入催化剂 D 减小A的物质的量
(4)能说明该反应已达到平衡状态的标志是_______(填字母)。
A 消耗5mol B的同时生成4molD
B 反应速率4v(B) = 5v (D)
C 容器内D的浓度不再随时间而发生变化
D 容器内压强不再随时间而发生变化
E 容器内混合气体的密度不再随时间而发生变化
(5)由图示求得平衡时A的转化率为________。
【答案】4A(g)+5B(g)![]() 6C(g)+4D(g) 0.1mol/(Lmin) = C CD 32%
6C(g)+4D(g) 0.1mol/(Lmin) = C CD 32%
【解析】
(1)根据图象知,A、B是反应物、C和D是生成物,反应达到平衡时,参加反应的物质的量变化量分别为:△n(A)=(2.5-1.7)mol=0.8mol、△n(B)=(2.4-1.4)mol=1.0mol、△n(C)=(1.2-0)mol=1.2mol、△n(D)=(0.8-0)mol=0.8mol,各物质的量的变化量之比等于其计量数之比,据此书写方程式;
(2)前2min内用A的浓度变化表示的化学反应速率![]() ;4min时,该反应达到平衡状态,反应速率之比等于其计量数之比;
;4min时,该反应达到平衡状态,反应速率之比等于其计量数之比;
(3)在2min时,各物质的物质的量不变,相同时间内物质的量变化量增大,说明加快反应速率;
(4)可逆反应达到平衡则![]() ,各物质的浓度不变,由此衍生的一些物理量也不变;
,各物质的浓度不变,由此衍生的一些物理量也不变;
(5)A的转化率=![]() ,以此计算。
,以此计算。
(1)根据图象知,A、B是反应物、C和D是生成物,反应达到平衡时,参加反应的物质的量变化量分别为:△n(A)=(2.51.7)mol=0.8mol、△n(B)=(2.41.4)mol=1.0mol、△n(C)=(1.20)mol=1.2mol、△n(D)=(0.80)mol=0.8mol,
各物质的量的变化量之比等于其计量数之比,所以A. B. C. D计量数之比=0.8mol:1.0mol:1.2mol:0.8mol=4:5:6:4,反应方程式为4A(g)+5B(g)6C(g)4D(g),
故答案为:4A(g)+5B(g)6C(g)4D(g);
(2)前2min内用A的浓度变化表示的化学反应速率![]() ;4min时,该反应达到平衡状态,反应速率之比等于其计量数之比,A. D的计量数相等,所以其反应速率相等,
;4min时,该反应达到平衡状态,反应速率之比等于其计量数之比,A. D的计量数相等,所以其反应速率相等,
故答案为:0.1mol/(Lmin);=;
(3)在2min时,各物质的物质的量不变,相同时间内物质的量变化量增大,说明加快反应速率,降低温度反应速率减慢,只有加入催化剂能加快反应速率且瞬间各物质的物质的量不变,故答案选C;
(4)A 消耗5mol B的同时生成4molD,均表示正反应速率,无法证明反应达到平衡,故A错误;
B 反应速率4v(B) = 5v (D),没有说明反应速率为正反应速率还是逆反应速率,无法证明反应达到平衡,故B错误;
C 容器内D的浓度不再随时间而发生变化,则能证明反应达到平衡,故C正确;
D 正反应为压强增大的反应,容器内压强不再随时间而发生变化,则可证明反应达到平衡,故D正确;
E根据质量守恒定律可知,反应前后混合气体的质量不变,容器为恒容容器,混合气体体积不变,则混合气体的密度始终不变,则无法用密度变化判断反应是否达到平衡,故E错误;故答案选:CD。
(5)A的转化率=![]() ,故答案为:32%。
,故答案为:32%。

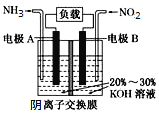
【题目】氮的化合物在工业中应用十分广泛。
(1)工业上尿素由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g); H=____________.
化学键 | 键能(KJ·mol-1) |
C=O | 728 |
C—N | 305 |
N—H | 389 |
O—H | 464 |
(2)工业上经常使用NaClO和NH3制取联氨,联氨(N2H4)为二元弱碱,在水中的电离方式与氨相似。写出联氨的电子式_________________。联氨与硫酸形成的酸式盐的化学式为__________________________________。联氨也经常作为燃料电池的环保原料使用,写出联氨在碱性电解质溶液中,负极的电极方程式_______________________________。
(3)已知合成氨反应的方程式为 N2+3H2![]() 2NH3,其平衡常数 K 的数值和温度的关系如下:
2NH3,其平衡常数 K 的数值和温度的关系如下:
温度℃ | 200 | 300 | 400 |
平衡常数K | 1 | 0.86 | 0.5 |
①由上表数据可知该反应H____0 (填“>”或“<”)。
②400 ℃时,测得某时刻 c(N2)= 5 mol·L-1、c(H2)= 3 mol·L-1、c(NH3)= 2 mol·L-1,此时刻该反应的 v 正____v 逆(填“>”“=”或“<”)。该反应达到平衡时,平衡混和气中N2的体积分数为____________
A.50% B.60% C.70% D.无法计算
(4)写出下列含氮化合物在特定条件下的水解反应,电负性Cl<N,尿素中的C显+4价,
①NCl3___________________________________________________________________________________________________________
②NF3____________________________________________________________________________________________________________