题目内容
【题目】如表是a~m九种元素在周期表中的位置,请回答下列问题:
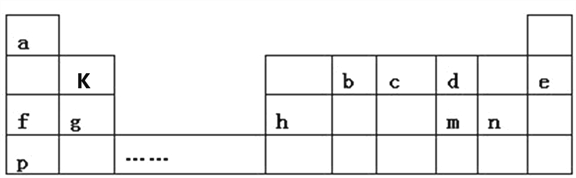
(1)m的阴离子结构示意图为____________。
(2)b的最高价氧化物的电子式为____________;用电子式表示f2 d2的形成过程_______________________。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___________(用离子符号填写)。
(4)f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为__________(填化学式)。
(5)p和n两种元素最高价氧化物的水化物相互反应的化学反应方程式为___________。
(6)c的氢化物和c的最高价氧化物对应水化物之间反应的化学方程式为__________。
(7)k的氧化物与氢氧化钠溶液反应的离子方程式为________________________。
(8)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。

①丁属于_____________(选填“离子化合物”或“共价化合物”)。
②请写出h单质与乙反应的化学方程式_____________。
【答案】 
![]()
![]() Cl->O2->Mg2+ KOH>NaOH>Mg(OH)2 KOH+HClO4=KClO4+H2O HNO3 + NH3 = NH4NO3 BeO+2OH-=BeO22-+H2O 离子化合物 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Cl->O2->Mg2+ KOH>NaOH>Mg(OH)2 KOH+HClO4=KClO4+H2O HNO3 + NH3 = NH4NO3 BeO+2OH-=BeO22-+H2O 离子化合物 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【解析】根据a~m九种元素在周期表中的位置可判断,它们分别是H、C、N、O、Ne、Na、Mg、Al、S,K是Be,p是K,n是Cl。则
(1)硫离子结构示意图为 。(2)b的最高价氧化物是二氧化碳,电子式为
。(2)b的最高价氧化物是二氧化碳,电子式为![]() ;过氧化钠的形成过程可表示为
;过氧化钠的形成过程可表示为![]() 。(3)核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数 增大而减小,则d、g、n形成的简单离子的半径由大到小的顺序为Cl->O2->Mg2+。(4)金属性越强,最高价氧化物水化物的碱性越强,则f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为KOH>NaOH>Mg(OH)2。(5)p和n两种元素最高价氧化物的水化物分别是氢氧化钾和高氯酸,相互反应的化学反应方程式为KOH+HClO4=KClO4+H2O。(6)c的氢化物氨气和c的最高价氧化物对应水化物硝酸之间反应的化学方程式为HNO3+NH3=NH4NO3。(7)k的氧化物与氧化铝的性质相似,与氢氧化钠溶液反应的离子方程式为BeO+2OH-=BeO22-+H2O。(8)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒,则甲是水,与金属钠反应生成氢氧化钠和氢气,铝与乙反应生成丙,则乙是氢氧化钠,丙是氢气,丁是偏铝酸钠。①偏铝酸钠含有离子键,属于离子化合物;②h单质与乙反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
。(3)核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数 增大而减小,则d、g、n形成的简单离子的半径由大到小的顺序为Cl->O2->Mg2+。(4)金属性越强,最高价氧化物水化物的碱性越强,则f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为KOH>NaOH>Mg(OH)2。(5)p和n两种元素最高价氧化物的水化物分别是氢氧化钾和高氯酸,相互反应的化学反应方程式为KOH+HClO4=KClO4+H2O。(6)c的氢化物氨气和c的最高价氧化物对应水化物硝酸之间反应的化学方程式为HNO3+NH3=NH4NO3。(7)k的氧化物与氧化铝的性质相似,与氢氧化钠溶液反应的离子方程式为BeO+2OH-=BeO22-+H2O。(8)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒,则甲是水,与金属钠反应生成氢氧化钠和氢气,铝与乙反应生成丙,则乙是氢氧化钠,丙是氢气,丁是偏铝酸钠。①偏铝酸钠含有离子键,属于离子化合物;②h单质与乙反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备实验流程如下:

已知:[Co(NH3)6]Cl3在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
温度(℃) | 0 | 20 | 47 |
溶解度(g) | 4.26 | 6.96 | 12.74 |
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸与研细的目的是__
(2)实验室制备三氯化六氨合钴(III)的化学方程式为:____________
(3)实验操作1为 _________[Co(NH3)6]Cl3溶液中加入浓盐酸的目的是_____
(4)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:[Co(NH3)6]Cl3+3NaOH![]() Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。
Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。

已知: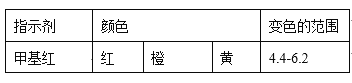
①当滴定到终点时,共需消耗NaOH溶液___mL(准确到0.01mL)。
②当用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将______(填“偏大”、“偏小”或“不变”)