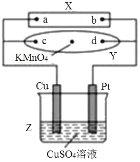
题目内容
【题目】高铁酸盐在能源、环保等方面有着广泛用途。
(1)化学氧化法生产高铁酸钾(K2FeO4)是用固体Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸钾和KNO2等产物。此反应中氧化剂与还原剂的物质的量之比为_____________。
(2)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图所示:
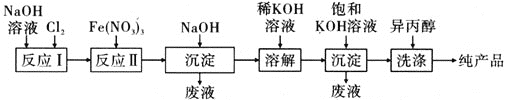
①反应Ⅰ的化学方程式为_________________________________________________。
②反应Ⅱ的离子方程式为_________________________________________________。
③加入饱和KOH溶液的目的是_________________________________________________。
④高铁酸钾是一种理想的水处理剂,其处理水的原理为____________________________。
⑤实验室配制Fe(NO3)3溶液,为防止出现浑浊,一般是将Fe(NO3)3固体溶于稀HNO3后再加水稀释。已知25 ℃时,Ksp[Fe(OH)3]=4×10-38,此温度下在实验室中配制100 mL 5 mol·L-1 Fe(NO3)3溶液,则至少需要________mL、4 mol·L-1 HNO3。

(3)高铁酸钠(Na2FeO4)制备可采用三室膜电解技术,装置如图所示,阳极的电极反应式为________。电解后,阴极室得到的A溶液中溶质的主要成分为________(填化学式)。
【答案】3∶1 2NaOH +Cl2=NaCl+NaClO+H2O 3ClO+10OH+2Fe3+=2FeO42-+3Cl+5H2O 增大K+浓度,促进K2FeO4晶体析出 K2FeO4具有强氧化性,能杀菌消毒,产生的Fe3+水解生成Fe(OH)3胶体具有吸附性 1.25 Fe6e+8OH=FeO42-+4H2O NaOH
【解析】
(1)由条件可知发生反应:![]() ,以此分析;
,以此分析;
(2)①反应Ⅰ:![]() ;②反应Ⅱ:
;②反应Ⅱ:![]() ;③加入饱和KOH溶液利用平衡
;③加入饱和KOH溶液利用平衡![]() 回答;④K2FeO4具有强氧化性,能杀菌消毒,产生的Fe3+水解生成Fe(OH)3胶体具有吸附性;⑤利用溶度积计算;
回答;④K2FeO4具有强氧化性,能杀菌消毒,产生的Fe3+水解生成Fe(OH)3胶体具有吸附性;⑤利用溶度积计算;
(3)阳极与电源正极相连为Fe极发生氧化反应:![]() ;阴极发生还原反应:
;阴极发生还原反应:![]() ,A溶液为NaOH。
,A溶液为NaOH。
(1)Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,N元素化合价由+5价降低+3价,![]() ,所以氧化剂与还原剂的物质的量之比为3:1,故答案为:3:1;
,所以氧化剂与还原剂的物质的量之比为3:1,故答案为:3:1;
(2)①反应Ⅰ为氧化还原反应,方程式为:![]() ;
;
②反应Ⅱ为氧化还原反应,+3价铁被氧化成+6价铁,+1价的氯被还原为-1价,
反应的离子方程式为![]() ,
,
③![]() ,加入饱和KOH溶液可以增大K+的浓度,使平衡向右移动,析出晶体,
,加入饱和KOH溶液可以增大K+的浓度,使平衡向右移动,析出晶体,
故答案为:增大K+的浓度,促进K2FeO4晶体析出;
④K2FeO4具有强氧化性,可用于杀菌消毒,可生成Fe(OH)3,具有吸附性,可除去水的悬浮性杂质,
故答案为:K2FeO4具有强氧化性,能杀菌消毒,产生的Fe3+水解生成Fe(OH)3胶体具有吸附性,
⑤根据溶度积公式![]() 可计算
可计算![]() ,由水的离子积可知
,由水的离子积可知![]() 。设需要xmL、4 mol·L-1HNO3,则xmL×4mol·L-1=0.05mol·L-1×100mL,解得x=1.25
。设需要xmL、4 mol·L-1HNO3,则xmL×4mol·L-1=0.05mol·L-1×100mL,解得x=1.25
故答案为:1.25。
(3)阳极是失去电子发生氧化反应,金属铁有还原性故阳极的电极反应为:![]() ;阴极氢离子得电子生成氢气,所以溶液中的溶质为NaOH;故答案为:
;阴极氢离子得电子生成氢气,所以溶液中的溶质为NaOH;故答案为:![]() ; NaOH。
; NaOH。

【题目】白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是

选项 | 试剂 | 现象 | 结论 |
A | 氯化铁溶液 | 溶液变色 | 含有羟基 |
B | 银氨溶液 | 有银镜产生 | 含有醛基 |
C | 碳酸氢钠溶液 | 有气泡产生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳双键 |
A. AB. BC. CD. D