题目内容
【题目】已知下列反应:
(Ⅰ)![]()
(Ⅱ)![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.反应Ⅰ中![]() 是氧化剂
是氧化剂
B.反应Ⅱ中![]() 发生氧化反应
发生氧化反应
C.还原性:![]()
D.氧化性:![]()
【答案】D
【解析】
所含元素化合价升高的反应物是还原剂,还原剂发生氧化反应得到氧化产物,还原剂失去电子具有还原性;所含元素化合价降低的反应物是氧化剂,氧化剂发生还原反应得到还原产物,氧化剂得到电子具有氧化性。一个氧化还原反应中,还原剂的还原性大于还原产物;氧化剂的氧化性大于氧化产物,据此回答。
A. 反应Ⅰ中![]() 是还原剂,A错误;
是还原剂,A错误;
B. 反应Ⅱ中![]() 发生还原反应,B错误;
发生还原反应,B错误;
C. 反应Ⅰ中![]() 是还原剂、
是还原剂、![]() 是还原产物,反应Ⅱ中
是还原产物,反应Ⅱ中![]() 是还原剂、
是还原剂、![]() 是还原产物,还原剂的还原性大于还原产物,因此还原性:
是还原产物,还原剂的还原性大于还原产物,因此还原性:![]() ,C错误;
,C错误;
D. 反应Ⅰ中![]() 是氧化剂、
是氧化剂、![]() 是氧化产物,反应Ⅱ中
是氧化产物,反应Ⅱ中![]() 是氧化剂、
是氧化剂、![]() 是氧化产物,氧化剂的氧化性大于氧化产物, 氧化性:
是氧化产物,氧化剂的氧化性大于氧化产物, 氧化性:![]() ,D正确;
,D正确;
答案选D。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
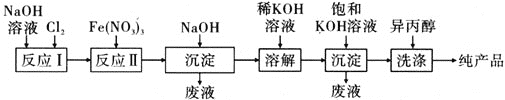
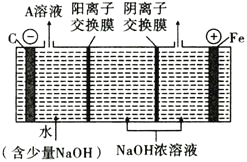
金牌教辅培优优选卷期末冲刺100分系列答案【题目】某烧碱样品因部分变质含Na2CO3。某化学课外小组的同学用滴定法测定该烧碱样品中NaOH的质量分数。
(资料)常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2 无色 8.2<pH<10浅红色 pH>10 红色
甲基橙:pH<3.1红色 3.1<pH<4.4橙色 pH>4.4 黄色
(实验步骤)
I. 迅速地称取烧碱样品0.50g,溶解后配制成100 mL溶液,备用。
Ⅱ.将0.1000mol/L HCl标准溶液装入酸式滴定管,调零,记录起始读数V0;用碱式滴定管取20.00 mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和NaHCO3),记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数V2。重复上述操作两次,记录数据如下:
实验序号 | 1 | 2 | 3 |
V0/ mL | 0.00 | 0.00 | 0.00 |
V1/ mL | 21.72 | 21.68 | 21.70 |
V2/ mL | 23.72 | 23.68 | 23.70 |
(1)步骤I中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和________。
(2)下列有关步骤I中样品溶液的说法正确的是________(填字母序号)。
a. 样品溶液中水的电离程度比相同pH的NaOH溶液中的小
b. c(OH-)>c(CO32-)>c(HCO3-)
c. c(H+)+ c(Na+)=c(CO32-)+c(HCO3-)+ c(OH-)
d. 向该溶液中滴加盐酸至第一终点时,n(Cl-)+n(CO32-)+n( HCO3-)+n(H2CO3)=n(Na+)
(3)酸式滴定管用蒸馏水洗净后、装入标准溶液前,应进行的操作是_______。
(4)滴定至第一终点的过程中,发生反应的离子方程式为_____。
(5)判断滴定至第二终点的现象是溶液由___色变为橙色。
(6)样品中NaOH的质量分数w(NaOH)= _____%。(计算结果保留小数点后1位)
(7)下列操作会导致测得的NaOH质量分数偏高的是____(填字母序号)。
a. 达到第一终点前,锥形瓶中有气泡产生
b. 记录酸式滴定管读数V1时,俯视标准液液面
c. 第一终点后继续滴定时,锥形瓶中有少许液体溅出