题目内容
8.在密闭体积不变的真空容器中加入一定量纯净的氨基甲酸铵固体,(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g),已知25℃时,平衡气体总浓度为2.4×10-3mol•L-1,下列说法中正确的是( )| A. | 密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态 | |
| B. | 20℃时,氨基甲酸铵的分解平衡常数为2.048×10-9mol3•L-3 | |
| C. | 恒温下压缩体积,NH3的体积分数不变 | |
| D. | 再加入一定量氨基甲酸铵,可加快正反应反应速率 |
分析 A.反应NH2COONH4(s)═2NH3(g)+CO2(g),生成的气体的物质的量之比始终是2:1,所以气体的平均相对分子质量始终不变;
B.根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
C.增大压强,平衡向着气体体积减小的方向移动,但体系中两种气体的物质的量之比始终不变;
D.固体物质的多少对化学反应速率没有影响.
解答 解:A.反应NH2COONH4(s)═2NH3(g)+CO2(g),生成的气体的物质的量之比始终是2:1,所以气体的平均相对分子质量始终不变,故不能作为平衡状态的判断依据,故A错误;
B.反应中生成的氨气和二氧化碳的浓度之比为2:1,总浓度为2.4×10-3mol/L,所以氨气的浓度为2.4×10-3mol/L×$\frac{2}{3}$=1.6×10-3mol/L,二氧化碳的浓度为.4×10-3mol/L×$\frac{1}{3}$=8.0×10-4mol/L,所以平衡常数K=c2(NH3)•c(CO2)=(1.6×10-3)2×8.0×10-4(mol/L)3=2.048×10-9(mol/L)3,故B正确;
C.恒温下压缩体积,压强增大,平衡逆向移动,但体系中两种气体的物质的量之比始终不变,所以氨气的体积分数不变,故C错误;
D.固体物质的多少对化学反应速率没有影响,故D错误;
故选B.
点评 本题主要考查平衡状态的判断、平衡常数的计算、平衡移动的影响因素等,难度中等,解题时要注意氨基甲酸铵是固体.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
18.标准状况下,下列关于等质量H2、D2、T2三种气体的叙述不正确的是( )
| A. | 相对分子质量之比为1:2:3 | B. | 质子数之比为2:3:6 | ||
| C. | 中子数之比为0:3:4 | D. | 体积之比为6:3:2 |
16.实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:①蒸馏 ②水洗 ③用干燥剂干燥 ④用10%的NaOH溶液洗.正确的操作顺序是( )
| A. | ①②③④ | B. | ④②③① | C. | ②④③① | D. | ④①②③ |
3.联三苯的结构是 ,其一氯代物(C18H13Cl)同分异构体数目为( )
,其一氯代物(C18H13Cl)同分异构体数目为( )
 ,其一氯代物(C18H13Cl)同分异构体数目为( )
,其一氯代物(C18H13Cl)同分异构体数目为( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
13.下列说法正确的是( )
| A. | 光导纤维、合成纤维和人造纤维都是有机高分子化合物 | |
| B. | 合金拓展了金属材料的使用范围,合金中也可能含有非金属元素 | |
| C. | H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 | |
| D. | 对“地沟油”进行分馏可以制得汽油、煤油,达到变废为宝的目的 |
20.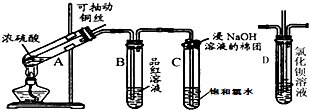 如图是研究铜与浓硫酸的反应装置:
如图是研究铜与浓硫酸的反应装置:
(1)A试管中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)反应一段时间后,可观察到B试管中的现象为溶液由红色变成无色.
(3)C试管口浸有NaOH溶液的棉团作用是吸收Cl2和SO2,防止污染空气.
(4)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是向上拉铜丝,终止反应,冷却后,将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色.
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
仅由上述资料可得出的正确结论是abd.
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol•L
d.硫酸浓度越大,黑色物质越快出现、越难消失.
 如图是研究铜与浓硫酸的反应装置:
如图是研究铜与浓硫酸的反应装置:(1)A试管中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)反应一段时间后,可观察到B试管中的现象为溶液由红色变成无色.
(3)C试管口浸有NaOH溶液的棉团作用是吸收Cl2和SO2,防止污染空气.
(4)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是向上拉铜丝,终止反应,冷却后,将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色.
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
| 资料1 |
| ||||||||||||
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. |
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol•L
d.硫酸浓度越大,黑色物质越快出现、越难消失.
18.天然提取和人工合成的有机物往往是混合物,假设给你一份有机混合物让你进行研究,一般要采取的几个步骤是( )
| A. | 分离、提纯→确定分子式→确定实验式→确定结构式 | |
| B. | 分离、提纯→确定实验式→确定分子式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定实验式→确定分子式 | |
| D. | 确定分子式→确定实验式→确定结构式→分离、提纯 |