题目内容
【题目】根据下列化合物:①HCl ②NaOH ③NH4Cl ④CH3COONa ⑤CH3COOH ⑥NH3H2O⑦Na2CO3,请根据字母序号提示的物质回答下列问题。
(1)③溶液中离子浓度大小顺序为______________________。用离子方程式表示⑦溶液显碱性的原因_______________________________。
(2)常温下,pH=11的④的溶液中,由水电离出来的c(OH-)=____________。已知常温下⑤和⑥的电离常数均为1.7×10-5 mol·L-1,则反应:CH3COOH+NH3H2O![]() CH3COO-+NH4++H2O的平衡常数为______________。
CH3COO-+NH4++H2O的平衡常数为______________。
(3)常温下,关于pH值相同的①和⑤两种溶液,下列说法不正确的是________。
A.两种溶液中水的电离程度相同 B.c(CH3COO-)=c(Cl-)
C.c(CH3COOH)>c(HCl) D.与等浓度的氢氧化钠溶液反应,醋酸消耗的体积少
(4)常温下,将0.10 mol/L的①溶液和0.30 mol/L;②溶液等体积混合,充分反应后恢复至常温,溶液的pH=________。
【答案】c(Cl-)>c(NH4+)>c(H+)>c(OH-) CO32-+H2O![]() HCO3-+OH- 1×10-3 mol/L 2.89×104 D 13
HCO3-+OH- 1×10-3 mol/L 2.89×104 D 13
【解析】
(1)NH4Cl为强酸弱碱盐,水解呈酸性;Na2CO3为强碱弱酸盐,水解呈碱性;
(2)CH3COONa为强碱弱酸盐,水解促进水的电离,醋酸抑制水的电离;
将反应CH3COOH+NH3H2O![]() CH3COO-+NH4++H2O的化学平衡常数表达式进行变形,带入CH3COOH和NH3H2O的电离平衡常数,就可得到反应的化学平衡常数的数值;
CH3COO-+NH4++H2O的化学平衡常数表达式进行变形,带入CH3COOH和NH3H2O的电离平衡常数,就可得到反应的化学平衡常数的数值;
(3)根据HCl是强酸,完全电离,CH3COOH是弱酸,部分电离,结合水电离平衡的影响因素分析判断;
(4)根据二者反应的物质的量关系,可知NaOH过量,溶液显碱性,然后计算反应后溶液中c(OH-),结合水的离子积常数及pH定义,计算溶液的pH。
(1)氯化铵为强酸弱碱盐,在溶液中电离NH4Cl=NH4++Cl-,NH4+发生水解反应,消耗水电离产生的OH-,最终达到平衡时溶液中c(H+)>c(OH-);水解呈酸性,铵根离子水解反应而消耗,所以c(Cl-)>c(NH4+),盐电离产生的NH4+浓度大于水电离产生的H+浓度,所以溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
Na2CO3为强碱弱酸盐,在溶液中CO32-发生水解反应:CO32-+H2O![]() HCO3-+OH-,水解产生的HCO3-会进一步水解:HCO3-+H2O
HCO3-+OH-,水解产生的HCO3-会进一步水解:HCO3-+H2O![]() H2CO3+OH-,主要是第一步水解反应。水解反应消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),所以水解后溶液呈碱性;
H2CO3+OH-,主要是第一步水解反应。水解反应消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),所以水解后溶液呈碱性;
(2)CH3COONa为强碱弱酸盐,pH=11的CH3COONa溶液中,c(H+)=10-11mol/L,由于在室温下水的离子积常数Kw=1×10-14,所以c(OH-)=![]() mol/L=1×10-3mol/L,溶液中OH-就是水电离产生,即CH3COONa溶液中,由水电离出来的c(OH-)=1×10-3mol/L,
mol/L=1×10-3mol/L,溶液中OH-就是水电离产生,即CH3COONa溶液中,由水电离出来的c(OH-)=1×10-3mol/L,
反应CH3COOH+NH3H2O![]() CH3COO-+NH4++H2O的平衡常数K=
CH3COO-+NH4++H2O的平衡常数K=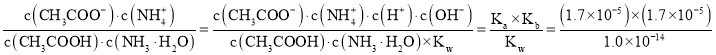 =2.89×104;
=2.89×104;
(3)HCl、CH3COOH 溶液的pH相同,则溶液中c(H+)相同,对水的电离平衡的抑制作用也相同,因此这两种溶液中水的电离程度相同,A正确;
B.在HCl、CH3COOH 溶液中都存在电荷守恒,两种溶液的pH相同,则两种溶液中c(H+)、c(OH-)也就相同,所以根据电荷守恒可知溶液中c(CH3COO-)=c(Cl-),B正确;
C.由于醋酸是弱酸,部分电离存在电离平衡,所以溶液中c(CH3COOH)>c(H+),而HCl是一元强酸,完全电离,溶液中c(H+)=c(HCl),所以pH相同的两种溶液中c(CH3COOH)> c(HCl),C正确;
D.由于溶液中的电解质的浓度c(CH3COOH)> c(HCl),所以与等浓度的氢氧化钠溶液反应,醋酸消耗NaOH的体积多,D错误;
故合理选项是D;
(4)HCl与NaOH混合会发生反应:HCl+NaOH=NaCl+H2O,二者反应的物质的量的比是1:1,常温下,将0.10 mol/L的HCl溶液和0.30 mol/L的NaOH溶液等体积混合,碱过量,溶液显碱性,混合后溶液中c(OH-)=![]() mol/L=0.10mol/L,由于在常温下Kw=1×10-14,所以溶液中c(H+)=1×10-13mol/L,因此该溶液的pH=13。
mol/L=0.10mol/L,由于在常温下Kw=1×10-14,所以溶液中c(H+)=1×10-13mol/L,因此该溶液的pH=13。