题目内容
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH![]() CH3COO-+H+ ΔH1>0 (K1=1.75×10-5)
CH3COO-+H+ ΔH1>0 (K1=1.75×10-5)
CH3COO-+H2O![]() CH3COOH+OH- ΔH2>0 ( K2=5.71×10-10 )
CH3COOH+OH- ΔH2>0 ( K2=5.71×10-10 )
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
A.混合溶液pH>7
B.对混合溶液进行微热,K1增大、K2减小
C.调节混合溶液的pH至中性,则此时溶液中c(Na+)=c(CH3COO-)
D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小
【答案】C
【解析】
试题分析:A.根据题干知,醋酸电离程度大于醋酸根离子水解程度,所以常温下,等体积、等物质的量浓度的醋酸和醋酸钠溶液混合后,溶液中存在c(OH-)<c(H+),呈酸性,所以混合溶液pH<7,A错误;B.醋酸电离和醋酸根离子水解都是吸热反应,升高温度促进醋酸电离、醋酸根离子水解,所以对混合溶液进行微热,K1增大、K2增大,B错误;C.溶液呈中性,则c(OH-)=c(H+),任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)=c(CH3COO-),C正确;D.温度不变,在混合溶液中加入少量NaOH固体,OH-和H+反应促进醋酸电离,则溶液中c(CH3COO-)增大,D错误;答案选C。

练习册系列答案
相关题目
【题目】如图所示,室温时甲、乙两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下止水夹K,使两瓶内气体充分接触后,容器内压强最小的是( )
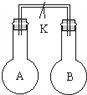
编号 | A | B | C | D |
甲中气体 | H2S | H2 | NH3 | NO |
乙中气体 | SO2 | Cl2 | HCl | O2 |
A. A B. B C. C D. D