题目内容
2.下列有关说法正确的是( )| A. | 已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-?I2+I- | |
| B. | 物质的量浓度相等的H2CO3和Na2CO3溶液等体积混合后的溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 | |
| D. | 25℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
分析 A、前者溶液变蓝,后者有黄色沉淀,则KI3的溶液中含I2、I-;
B、物质的量浓度相等的H2CO3和Na2CO3溶液等体积混合后的溶液是NaHCO3溶液,碳酸氢根离子的水解程度大于其电离程度;
C、据其Qc与Ksp大小判断;
D、在酸碱溶液中水的电离受到抑制.
解答 解:A、向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,则KI3的溶液中含I2、I-,即KI3溶液中存在平衡为I3-?I2+I-,故A正确;
B、物质的量浓度相等的H2CO3和Na2CO3溶液等体积混合后的溶液是NaHCO3溶液,碳酸氢根离子的水解程度大于其电离程度,c(OH-)>c(CO32-),故B错误;
C、Qc(Ag2CrO4)=(5×10-5mol/L)2×5.0×10-5mol/L<Ksp(Ag2CrO4)=2.0×10-12,无Ag2CrO4沉淀产生,故C错误;
D、在酸碱溶液中水的电离受到抑制,所以在酸碱溶液中25℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定小于10-14,故D错误;
故选A.
点评 本题考查了离子检验、沉淀的溶解平衡、离子浓度的大小比较、水的离子积常数,是高考高频考点,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1molCl2与足量的Fe充分反应,转移电子的数目为3NA | |
| B. | 常温下,1LpH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| C. | 常温下,21g乙烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1mol${\;}_{6}^{14}$C原子中所含中子数目为6NA |
7.将三种黑色粉末组成的混合物加入到足量的某热浓酸中,充分反应后得到蓝绿色溶液和两种气体,将从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀;将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,据此推断黑色粉末可能为( )
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | B. | 物质的量 C:CuO:Fe=3:2:2 | ||
| C. | 质量 MnO2:CuO:C=5.5:8:12 | D. | 质量 Fe:C:CuO=7:5:3 |
14.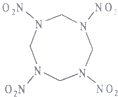 高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )
高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )
 高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )
高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )| A. | HMX分子式为C4N8O8 | |
| B. | HMX中,所有C、N原子共平面 | |
| C. | 爆炸反应是,N2既是还原产物又是氧化产物 | |
| D. | 29.6gHMX完全燃烧产生二氧化碳8.96L |
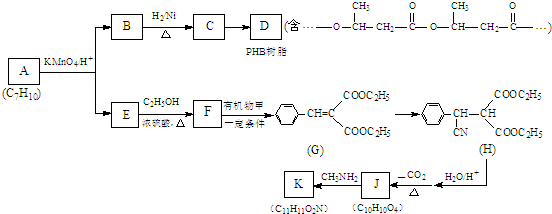
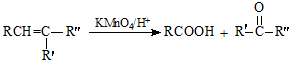
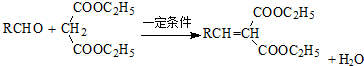
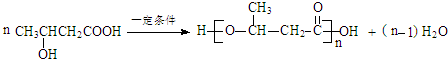 .
. .
.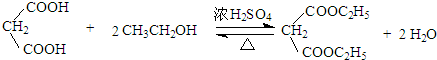 .
.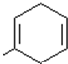 .
.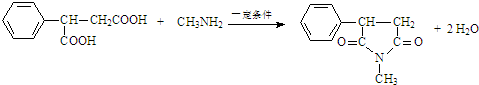 .
.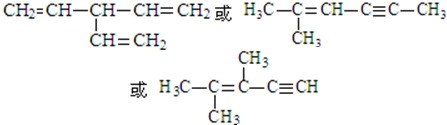 (写出一种即可).
(写出一种即可).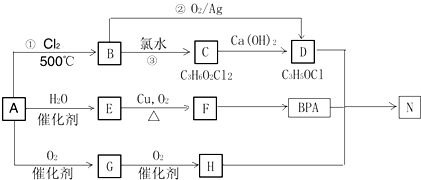
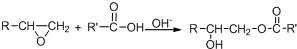
 .
.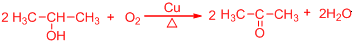 .
.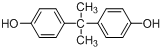 所示,下列说法正确的是ab.
所示,下列说法正确的是ab. .
.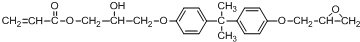
 (其中两种).
(其中两种).
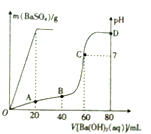 常温下,向80mL由盐酸和硫酸组成的混合溶液中加入0.4 mol•L-1的Ba(OH)2溶液,生成BaSO4沉淀的质量及溶液pH随加入Ba(OH)2溶液的体积的关系如图所示.
常温下,向80mL由盐酸和硫酸组成的混合溶液中加入0.4 mol•L-1的Ba(OH)2溶液,生成BaSO4沉淀的质量及溶液pH随加入Ba(OH)2溶液的体积的关系如图所示.