题目内容
17.为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫.(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料.请写出焦炭与水蒸气高温下反应的化学方程式:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体.
已知:①2CO(g)+O2(g)=2CO2(g)△H1=-566kJ?mol-1
②2NO(g)+2CO(g)?N2(g)+2CO2(g)△H2=-746kJ?mol-1
则反应N2(g)+O2(g)=2NO(g)的△H=+180kJ?mol-1.
(3)在一定温度下,向1L密闭容器中充入0.5mol NO、2mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6mol.在该温度下反应的平衡常数K=1.25.
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图1是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为CO2+2e-+2H+=HCOOH.

(5)氮氧化物进入水体可转化为NO3─,电化学降解法可用于治理水中NO3─的污染.原理如图2所示.电源正极为A(填“A”或“B”),若电解过程中转移了0.4mol电子,则处理掉的NO3─为4.96g.
分析 (1)根据质量和原子守恒,焦炭与水蒸气高温下反应生成两种可燃性气体,据此书写方程式;
(2)据热化学方程式和盖斯定律计算;
(3)结合平衡三段式列式计算平衡浓度,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
(4)由图可知,左室投入是水,生成氧气与氢离子,催化剂a表面发生氧化反应,为负极,右室催化剂b表面通入二氧化碳,酸性条件下生成HCOOH,电极反应式为CO2+2H++2e-=HCOOH;
(5)该装置中,硝酸根离子得电子发生还原反应,则Ag-Pt电极为阴极,反应式为2NO3-+6H2O+10e-=N2↑+12OH-,Pt电极为阳极,连接阳极的电极为正极,据此分析计算;
解答 解:(1)根据质量和原子守恒,焦炭与水蒸气高温下反应生成两种可燃性气体为CO和H2,则反应的方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,故答案为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)①2CO(g)+O2(g)=2CO2(g)△H1=-566kJ?mol-1
②2NO(g)+2CO(g)?N2(g)+2CO2(g)△H2=-746kJ?mol-1
依据盖斯定律计算①-②得到反应的热化学方程式为:N2(g)+O2(g)=2NO(g),△H=(-566+746)=+180KJ/mol;故答案为:+180;
(3)在一定温度下,向1L密闭容器中充入0.5mol NO、2mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6mol,依据化学平衡三段式列式计算:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol) 0.5 2 0 0
变化量(mol) 0.4 0.4 0.2 0.4
平衡量(mol) 0.1 1.6 0.2 0.4
体积为1L,物质的量数值为浓度数值,计算得到平衡常数K=$\frac{0.2×0.4{\;}^{2}}{0.1{\;}^{2}×1.6{\;}^{2}}$=1.25;
故答案为:1.25;
(4)由图可知,左室投入是水,生成氧气与氢离子,催化剂a表面发生氧化反应,为负极,右室催化剂b表面通入二氧化碳,酸性条件下生成HCOOH,电极反应式为CO2+2H++2e-=HCOOH,故答案为:CO2+2e-+2H+=HCOOH;
(5)根据图知,电解槽右边部分N元素化合价由+5价变为0价,所以硝酸根离子发生还原反应,则Ag-Pt电极为阴极,反应式为2NO3-+6H2O+10e-=N2↑+12OH-,Pt电极为阳极,所以A是正极;又转移了0.4mol电子,根据阴极反应式,则消耗的硝酸根为$\frac{0.4}{10}$×2×62=4.96g,故答案为:A;4.96;
点评 本题考查了热化学方程式的书写方法,化学平衡的计算分析判断,原电池和电解池的原理的分析与计算,题目难度中等.

| A. | 自行车的钢圈上镀一层铬,防止生锈 | |
| B. | 外加直流电源保护钢闸门时,钢闸门与电源的负极相连 | |
| C. | 钢铁发生吸氧腐蚀的正极反应:2H2O+O2+4e-═4OH- | |
| D. | 钢铁发生析氢腐蚀的负极反应:Fe-3e-═Fe3+ |
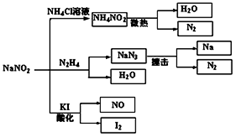 亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生.它的部分性质如图,下列说法错误的是( )
亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生.它的部分性质如图,下列说法错误的是( )| A. | 可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2) | |
| B. | N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键 | |
| C. | NaNO2与N2H4生成NaN3的反应方程式为:NaNO2+N2H4═NaN3+2H2O | |
| D. | 如图所涉及到的化学反应都是氧化还原反应 |
| A | B | C | D | |
| 用途 | 热的纯碱溶液可去油污 | 明矾可用于净水 | 抗坏血酸(Vc)可作抗氧化剂 | 液氨可做制冷剂 |
| 解释 | 纯碱水解呈碱性 | 明矾在水中生成的氢氧化铝胶体有吸附性 | Vc具有酸性 | 液氨汽化时吸收大量的热 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-?I2+I- | |
| B. | 物质的量浓度相等的H2CO3和Na2CO3溶液等体积混合后的溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 | |
| D. | 25℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
| A. | 0.2mol•L-1 H2C2O4溶液:C(H+)>C(H2C2O4)>C(H2C2O4-)>C (C2O42-) | |
| B. | 常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合后所得溶液的PH<7 | |
| C. | 在(NH4)2SO4溶液中,C(NH4+)+C(NH3•H2O)=$\frac{1}{2}$C(SO42-) | |
| D. | 叠氮酸(HN3)与醋酸性相似,0.1 mol•L-1NaN3溶液:C (N3-)>C(Na+)>C(OH-)>C (H+) |
| A. | 加成→消去→取代 | B. | 消去→加成→取代 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |