题目内容
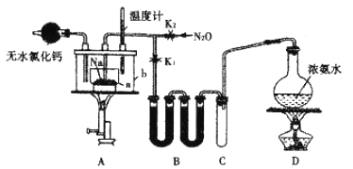
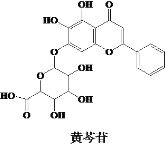
【题目】钛合金材料已经广泛应用于国防、航天、医疗等领域。已知常温下钛(Ti)与酸、碱均不反应,高温下能被空气氧化。由钛铁矿(主要成分为FeO·TiO2)提取金属钛的主要流程如图所示。有关叙述错误的是( )
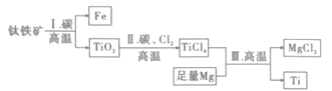
A.步骤Ⅰ、Ⅱ中的碳均作还原剂B.可用稀硫酸或稀盐酸除去金属钛中的少量镁
C.钛元素位于元素周期表中第ⅡB族 D.步骤Ⅲ需在氩气氛围中进行,防止金属被空气氧化
【答案】C
【解析】
由流程可知,I中发生2FeO+C![]() CO2↑ +2Fe,Ⅱ中发生高温TiO2 + 2C+ 2Cl2
CO2↑ +2Fe,Ⅱ中发生高温TiO2 + 2C+ 2Cl2![]() TiCl4 + 2CO,Ⅲ中发生2Mg+ TiCl4
TiCl4 + 2CO,Ⅲ中发生2Mg+ TiCl4![]() 2MgCl2 + 2Ti,以此来解答。
2MgCl2 + 2Ti,以此来解答。
A、步骤I、II中C的化合价均升高,所以C作还原剂,A不符合题意;
B、Ti与酸不反应,Mg可溶于稀硫酸或稀盐酸,B不符合题意;
C、钛元素位于元周期表中第ⅣB族,C符合题意;
D、因为Ti高温下能被空气氧化,D不符合题意;
故答案为:C。

【题目】(1)乙醇(C2H5OH)是未来内燃机的首选环保型液体燃料,它可以由绿色植物的秸秆制取,1.0g乙醇完全燃烧生成液态水放出1.367kJ热量,表示乙醇燃烧热的热化学方程式_____________。
(2)断开1molAB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:
化学键 | H-H | O=O | O-H |
E/kJ·mol-1 | 436 | x | 463 |
请回答下列问题:
①如图表示某反应的能量变化关系,则此反应为________(填“吸热”或“放热”)反应,其中ΔH=__________(用含有a、b的关系式表示)。
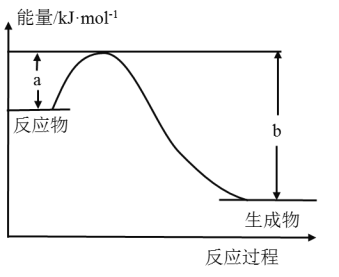
②若图示中表示反应H2(g)+![]() O2(g)=H2O(g)ΔH=-241.8kJ·mol-1,则b=_______kJ·mol-1,x=________。
O2(g)=H2O(g)ΔH=-241.8kJ·mol-1,则b=_______kJ·mol-1,x=________。