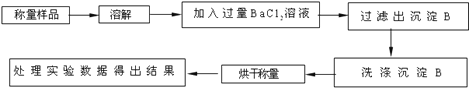
题目内容
【题目】一定条件下铁可以和CO2发生反应Fe(s)+ CO2(g)![]() FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
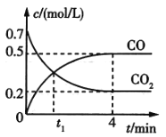
(1)t1min时,正、逆反应速率的大小关系为v正__v逆(填“>”“<”或“=”).
(2)0~4min内,CO2的转化率为__,CO的平均反应速率,v(CO)=__。
(3)下列条件的改变能减慢上述反应的反应速率的是__(填序号,下同)。
①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大 ④保持体积不变,充入He使体系压强增大
(4)下列选项能说明上述反应已达平衡状态的是__。
①v(CO2)=v(CO)
②单位时间内生成nmolCO2的同时生成nmolCO
③容器中气体压强不随时间的变化而变化
④容器中气体的平均相对分子质量不随时间的变化而变化
【答案】> 71.4% 0.125mol/(L·min) ①③ ②④
【解析】
(1)反应往正方向进行则![]() ,反应往逆方向进行则
,反应往逆方向进行则![]() ;
;
(2)![]() ,
,![]() ,以此计算;
,以此计算;
(3)根据影响化学反应速率的因素进行判断;
(4)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
(1)根据图象可知,在![]() 后,CO浓度增大、
后,CO浓度增大、![]() 浓度减小,说明
浓度减小,说明![]() 时反应未达到平衡,反应正向进行,因此
时反应未达到平衡,反应正向进行,因此![]() ,故答案为:>;
,故答案为:>;
(2)根据图象可知,反应开始时![]() 的浓度是0.7mol/L,4min时
的浓度是0.7mol/L,4min时![]() 浓度是0.2mol/L,所以0~4min内,
浓度是0.2mol/L,所以0~4min内,![]() 的转化率为
的转化率为![]() ;0~4min内CO的平均反应速率
;0~4min内CO的平均反应速率![]() ,故答案为:71.4%;0.125mol/(L·min);
,故答案为:71.4%;0.125mol/(L·min);
(3)①降低温度,化学反应速率降低,①符合题意;
②由于固体的浓度始终不变,所以减少铁粉的质量对反应速率没有影响,②不符合题意;
③保持压强不变,充入He使容器的体积增大,反应体系中各气体的浓度降低化学反应速率降低,③符合题意;
④保持体积不变,充入He使体系压强增大,由于体系中各气体的浓度不变,所以化学反应速率不变,④不符合题意;
故答案为:①③;
(4)①未指明正、逆反应速率,因此不能判断是否为平衡状态,①错误;
②单位时间内生成![]() 的同时必然会消耗
的同时必然会消耗![]() ,又生成
,又生成![]() ,则CO的物质的量不变,反应达到平衡状态,②正确;
,则CO的物质的量不变,反应达到平衡状态,②正确;
③该反应是反应前后气体体积不变的反应,即体系的压强始终不变,因此不能据此判断反应是否为平衡状态,③错误;
④若容器中气体的平均相对分子质量不随时间而变化,因该反应不是纯气体反应,说明气体的质量不再发生变化,则反应达到平衡状态,④正确;
故答案为:②④。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】下表是3种物质的溶解度![]() ,下列说法中正确的是
,下列说法中正确的是![]()
物质 |
|
|
|
溶解度 | 74 |
|
|
A.已知![]() 的
的![]()
![]() ,则所有含有固体
,则所有含有固体![]() 的溶液中,都有
的溶液中,都有![]() ,且
,且![]()
![]()
B.除去粗盐中含有的![]() 杂质,最佳除杂试剂为
杂质,最佳除杂试剂为![]() 溶液
溶液
C.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
D.用石灰水处理含有![]() 和
和![]() 的硬水,发生的离子反应方程式为
的硬水,发生的离子反应方程式为![]()