题目内容
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子最外层电子数之和与Ca2+的核外电子数相等,Y、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
| A.原子半径:Z>Y>X | B.Z与X在同一周期 |
| C.氢化物的稳定性:X>Y | D.XZ4属于共价化合物 |
D
解析试题分析:3种元素的原子最外层电子数之和与Ca2+的核外电子数相等,应为18,Y、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构,应分别为F、Cl,则X的最外层电子数为4,应为C元素,
A.原子半径应为Cl>C>F,故A错误;B.由以上分析可知X和Z分别位于周期表第二周期和第三周期,故B错误;C.非金属性C<F,氢化物的稳定性:C<F,故C错误;D.XZ4为CCl4,为共价化合物,故D正确.故选D.
考点:原子结构与元素周期率的关系

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
短周期元素的四种离子aW3+、bX+、cY2-、dZ- 它们的电子层结构相同,下列关系正确的是
| A.质子数c>d | B.离子的还原性Y2->Z- |
| C.氢化物的稳定性H2Y>HZ | D.原子半径X<W |
已知33As、35Br位于同一周期,下列关系正确的是
| A.原子半径:As>C1>P | B.热稳定性:HC1>AsH3>HBr |
| C.还原性:As3->S2->C1- | D.酸性:H3AsO4>H2SO4>H3PO4 |
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,它们的部分化合价如下表。下列说法正确的是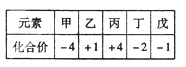
| A.乙的单质中能与水剧烈反应 |
| B.气态氢化物的稳定性:丙>甲 |
| C.丙的氧化物能与戊的氢化物水溶液反应 |
| D.其最高价氧化物对应的水化物的酸性:丁>戊 |
依据元素周期表及元素周期律,下列推断正确的是
| A.HCl、HBr、HI的热稳定性依次增强 |
| B.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
| C.同主族元素从上到下,单质的熔点逐渐降低 |
| D.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
符号“3p”没有给出的信息是
| A.能级 | B.电子层 | C.电子亚层 | D.电子云在空间的伸展方向 |
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
| A.Z元素的原子半径可能比Y元素的小 |
| B.W的原子序数可能是Y的原子序数的2倍 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.Z的化学活泼性一定比X强 |