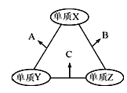
题目内容
【题目】2019 年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCoO2 和 LiMnO2 等都是他们研究锂离子电池的载体。回答下列问题:
(1)基态 Ti 原子的价层电子排布图为____。
(2)在第四周期 d 区元素中,与 Ti 原子未成对电子数相同的元素名称________。
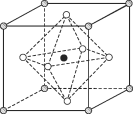
(3)金属钛的原子堆积方式如图所示,则金属钛晶胞俯视图为______。
![]()
(4)已知第三电离能数据:I3(Mn)=3246 kJ·mol-1,I3(Fe)=2957 kJ·mol-1。锰的第三电离能大于铁的第三电离能,其主要原因是______。
(5)据报道,在 MnO2 的催化下,甲醛可被氧化成 CO2,在处理含 HCHO 的废水或空气方面有广泛应用。HCHO中键角________CO2 中键角(填“大于”“小于”或“等于”)。
(6)Co3+、Co2+能与 NH3、H2O、SCN-等配体组成配合物。
①1 mol[ Co(NH3)6]3+含______mol σ键。
②配位原子提供孤电子对与电负性有关,电负性越大,对孤电子对吸引力越大。SCN-的结构式为[S=C=N] -,SCN-与金属离子形成的配离子中配位原子是_______(填元素符号)。
(7)工业上,采用电解熔融氯化锂制备锂,钠还原 TiCl4(g)制备钛。已知:LiCl、TiCl4的熔点分别为 605℃、-24℃,它们的熔点相差很大,其主要原因是________。
(8)钛的化合物晶胞如图所示。

二氧化钛晶胞如图 1 所示,钛原子配位数为______。氮化钛的晶胞如图 2 所示, 图 3 是氮化钛的晶胞截面图(相邻原子两两相切)。已知:NA 是阿伏加德罗常数的值,氮化钛晶体密度为 d g·cm-3。氮化钛晶胞中 N 原子半径为________pm。
【答案】![]() 镍 D Mn2+价层电子排布式为3d54s2达到稳定结构,不易失电子形成Mn3+,Fe2+价电子排布式为3d6,要失去1个电子才达到稳定结构,较易形成Fe3+,所以锰的第三电离能大于铁 小于 24 S 氯化锂是离子化合物,属于离子晶体,氯化钛是共价化合物,属于分子晶体,离子晶体里的离子键要比分子晶体里的分子间作用力强 6
镍 D Mn2+价层电子排布式为3d54s2达到稳定结构,不易失电子形成Mn3+,Fe2+价电子排布式为3d6,要失去1个电子才达到稳定结构,较易形成Fe3+,所以锰的第三电离能大于铁 小于 24 S 氯化锂是离子化合物,属于离子晶体,氯化钛是共价化合物,属于分子晶体,离子晶体里的离子键要比分子晶体里的分子间作用力强 6 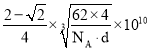
【解析】
(1)基态Ti原子的价电子排布式为3d24s2,结合泡利原理、洪特规则画出价电子排布图;
(2)在第四周期d区元素中,与Ti原子未成对电子数相同,该元素核外电子排布式为[Ar]3d84s2;
(3)Ti原子密置层排列为ABABAB…排列方式,属于六方最密堆积,平行六面体的晶胞上下底面为菱形,平行六面体均分为2个正三棱柱,其中1个正三棱柱的中心有1个Ti原子,金属钛晶胞俯视图与D相符合;
(4)原子轨道处于半满、全满时能量更低更稳定;
(5)HCHO和CO2中C原子杂化方式不同;
(6)①1个[Co(NH3)6]3+中含有18个共价键,6个配位键,配位键也是σ键;②SCN-的结构式为[S=C=N]-,C原子没有孤对电子,N和S都有孤对电子,电负性越大,对孤电子对吸引力越大;
(7)离子晶体比分子晶体熔点高;
(8)由图1里面1个晶胞里Ti、O两种原子的个数可知Ti原子的配位数,由图2可知1个晶胞里各原子的个数,计算出晶胞的质量,结合密度计算晶胞的体积,晶胞的体积开三次方得到晶胞的棱长,再由图3中两种原子半径与棱长的关系进行计算;
根据以上分析进行解答。
(1)Ti的原子序数为22,根据能级图及能量构造原理可得核外电子排布式为:1s22s22p63s23p63d24s2,价电子排布式为3d24s2,价电子排布图为:![]() 。
。
答案为:![]() 。
。
(2)Ti原子未成对电子数为2,在第四周期d区元素中,与Ti原子未成对电子数相同的元素的电子排布式为:1s22s22p63s23p63d84s2,为镍元素。
答案为:镍。
(3)根据金属钛的原子堆积方式可知,该堆积方式为ABABABA…晶胞结构为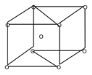 ,故金属钛晶胞俯视图为D。
,故金属钛晶胞俯视图为D。
答案为:D。
(4)Mn2+价层电子排布式为3d54s2达到稳定结构,不易失电子形成Mn3+,Fe2+价电子排布式为3d6,要失去1个电子才达到稳定结构,较易形成Fe3+,所以锰的第三电离能大于铁。
答案为:Mn2+价层电子排布式为3d54s2达到稳定结构,不易失电子形成Mn3+,Fe2+价电子排布式为3d6,要失去1个电子才达到稳定结构,较易形成Fe3+,所以锰的第三电离能大于铁。
(5)HCHO分子是平面结构,键角接近120,而CO2的键角是180,C原子的杂化类型不同,键角不同。
答案:小于。
(6)①1个NH3含有3个共价键,还能形成1个配位键,共价键和配位键都是σ键,所以1mol[Co(NH3)6]3+含24molσ键。
答案:24。
②SCN-的结构式为[S=C=N]-,C原子没有孤对电子,N和S原子都有孤对电子,电负性越大对孤电子对吸引力越强,越不易给出电子形成配位键,N的电负性大于S,所以SCN-与金属离子形成的配离子中配位原子是S。
答案为:S。
(7)依题意,氯化锂是离子化合物,属于离子晶体,氯化钛是共价化合物,属于分子晶体,离子晶体里的离子键要比分子晶体里的分子间作用力强,所以离子晶体的熔点比较高。
答案为:氯化锂是离子化合物,属于离子晶体,氯化钛是共价化合物,属于分子晶体,离子晶体里的离子键要比分子晶体里的分子间作用力强。
(8)图1中,由均摊法可知1个晶胞含2个黑球4个白球(2个白球在体内,4个白球在面心),所以黑球为钛,白球为氧,1个钛与6个氧相连,钛的配位数为6;由图2可知1个晶胞含4个TiN,TiN的相对式量为62,图3棱上三个粒子相切,设晶胞棱长为a,d=![]() ,a=
,a= ,[4r(Ti)]2=2a2,r(Ti)=
,[4r(Ti)]2=2a2,r(Ti)=![]() a,2r(Ti)+2r(N)=a,r(N)=
a,2r(Ti)+2r(N)=a,r(N)=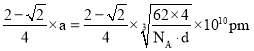 。
。
答案为:6;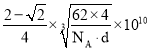 。
。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
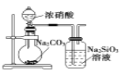
芒果教辅暑假天地重庆出版社系列答案【题目】下列实验的现象与结论相对应的是
A | B | C | D | |
实验 |
|
|
|
|
现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | 烧瓶中有大量气泡冒出,Na2SiO3溶液变浑浊 |
结论 | 铁片作负极,片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | 非金属性: N>C>Si |
A.AB.BC.CD.D