题目内容
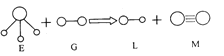
【题目】已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),如右图:
下列判断错误的是
A.G是最活泼的非金属单质B.L能使紫色石蕊试液变红色
C.E能使紫色石蕊试液变蓝色D.M是化学性质很活泼的单质
【答案】D
【解析】
组成E、G、L、M分子的元素原子序数均小于10,由反应物和生成物的结构式可知,G、M为单质,E、L为化合物,E分子为三角锥形,G、L、M都是直线形分子,M为含有3对共用电子对的单质,M为N2,E为NH3,G为F2,L为HF;
A.F的非金属性最强,则对应的F2单质是最活泼的非金属单质,A项正确;
B.L为HF,氢氟酸是弱酸,能使紫色石蕊试液变红色,B项正确;
C.E为NH3,溶液呈碱性,能使紫色石蕊试液变蓝色,C项正确;
D.M为N2,由于氮氮三键的键能较大,N2的化学性质稳定,D项错误;
答案选D。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3- |
B | 向1 mL浓度均为0.05 mol·L-l NaCl、NaI的混合溶液中滴加2滴0.01 mol·L-l AgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
C | 室温下,用 pH 试纸分别测定浓度为 0.1mol/L NaClO溶液和0.1mol/L CH3COONa溶液的pH | 比较HC1O和CH3COOH的酸性强弱 |
D | 浓硫酸与乙醇180℃共热,制得的气体通入酸性KMnO4 溶液,溶液紫色褪去 | 制得的气体为乙烯 |
A.AB.BC.CD.D