题目内容
【题目】如图为几种有机化合物的结构简式:
①CH3CH=CHCH2CH3② ③CH3CH2CH2CH2OH④CH3—C≡C—CH3⑤ CH3—CH2—C≡CH⑥
③CH3CH2CH2CH2OH④CH3—C≡C—CH3⑤ CH3—CH2—C≡CH⑥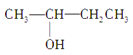 ⑦CH3CH2CH2OCH3⑧
⑦CH3CH2CH2OCH3⑧![]() ⑨CH2=CH—CH=CH2⑩ CH2=CHCH2CH2CH3
⑨CH2=CH—CH=CH2⑩ CH2=CHCH2CH2CH3
(1)属于同分异构体的是______、______、__________、__________。
(2)属于官能团位置不同的同分异构体是:________、__________、________。
(3)属于官能团类型不同的同分异构体是:____、____、____、____、____。
【答案】①⑩ ②⑧ ③⑥⑦ ④⑤⑨ ①⑩ ③⑥ ④⑤ ③⑦ ④⑨ ⑤⑨ ⑥⑦ ②⑧
【解析】
同分异构体是分子式相同,结构不同的物质互为同分异构体,碳链异构:由于分子中碳链形状不同而产生的异构现象;位置异构:由于取代基或官能团在碳链上或碳环上的位置不同而产生的异构现象,官能团异构:分子中由于官能团不同而产生的异构现象。
①CH3CH═CH﹣CH2CH3 、⑩CH2=CH﹣CH2CH2CH3分子式相同,碳碳双键位置不同,二者属于位置异构;
④CH3﹣C≡C﹣CH3,⑤CH3﹣CH2﹣C≡CH,⑨CH2=CH﹣CH=CH2,三种分子式相同、结构不同,属于同分异构体,其中④⑤碳碳三键位置不同,属于位置异构,④、⑤与⑨的官能团不同,属于官能团异构;
③CH3CH2﹣CH2﹣CH2OH、⑥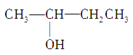 、⑦CH3CH2CH2OCH3,分子相同,结构不同,三种互为同分异构体,③⑥羟基位置不同,属于位置异构,③、⑥与⑦的官能团不同,属于官能团异构;
、⑦CH3CH2CH2OCH3,分子相同,结构不同,三种互为同分异构体,③⑥羟基位置不同,属于位置异构,③、⑥与⑦的官能团不同,属于官能团异构;
② 、⑧
、⑧![]() 的分子式相同,前者含有碳碳双键,或者含有环状,属于官能团异构;
的分子式相同,前者含有碳碳双键,或者含有环状,属于官能团异构;
(1)根据分析可知,互为同分异构体的有:①⑩、②⑧、③⑥⑦、④⑤⑨;
(2)属于官能团位置不同的同分异构体是:①⑩、③⑥、④⑤;
(3)属于官能团类型不同的同分异构体是:③⑦、④⑨、⑤⑨、⑥⑦、②⑧。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)11种元素中,化学性质最不活泼的是_____。非金属性最强的元素的原子结构示意图为______。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是___________。
(3)②③④的原子半径由大到小的顺序是_________。
(4)元素⑦的氢化物常温下和元素②的单质反应的子方程式是________。
(5)⑧的最高价氧化物对应的水化物化学式为__________。
(6)①、⑥和⑦形成的化合物的化学式为______。该化合物的化学键类型为_________。
(7)⑧⑨三种元素形成的气态氢化物最稳定的是_______。
(8)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为________。
(9)下列可以判断①和⑤金属性强弱的是_______________。
a. ①单质的熔点比⑤单质低
b. ①质软,氧化物种类比⑤多
c. ①单质与水反应,⑤单质几乎不与水反应
d. ①最高价氧化物的水化物的碱性比⑤强