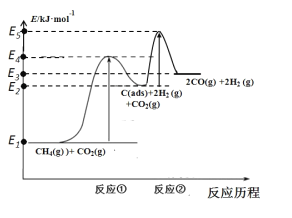
题目内容
【题目】“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)CO 还原 NO 的反应为 2CO(g)+ 2NO(g)2CO2 (g)+ N2 (g) H= -746kJmol-1。部分化学键的键能数据如下表(CO 以 C≡O 键构成):
化学键 | C≡O | N≡N | C=O |
E/(kJ·mol-1) | 1076 | 945 | 745 |
① 由以上数据可求得 NO 的键能为________________kJ·mol-1。
② 写出两条有利于提高 NO 平衡转化率的措施______________。
(2)一定条件下,向某恒容密闭容器中充入 x mol CO2 和 y mol H2,发生的反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH= 50 kJmol1。
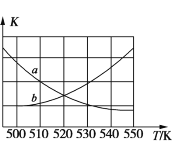
①图中能表示该反应的平衡常数 K 与温度 T 之间的变化关系曲线为____________ (填“a”或“b”),其判断依据是________ 。
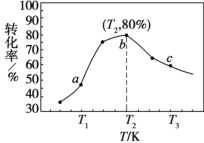
②若 x=2、y=3,测得在相同时间内不同温度下 H2 的转化率如图所示,则在该时间段内, 恰好达到化学平衡时,此时容器内的压强与反应开始时的压强之比为________。
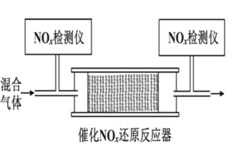
(3)在有氧条件下,新型催化剂 M 能催化 NH3 与 NOx 反应生成 N2。
① NH3 与 NO2 生成 N2 的反应中,当生成 28g N2 时,转移的电子数为_______________mol(结果保留三位有效数字)。
② 将一定比例的 O2、NH3 和 NOx 的混合气体,匀速通入装有催化剂 M 的反应器中反应(装置如图)。
反应相同时间 NOx 的去除率随反应温度的变化曲线如图所示:
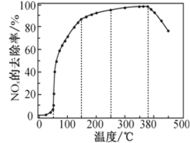
在 50~250 ℃范围内随着温度的升高,NOx 的去除率先迅速上升后上升缓慢的主要原因是_______________;当反应温度高于 380 ℃时,NOx 的去除率迅速下降的原因可能是_________。
【答案】513.5 增大压强、降低温度、增大CO与NO的投料比 a 该反应是放热反应,升高温度不利于反应向右进行,会使平衡常数减小 17:25 ![]() 在一定温度范围内催化剂活性较大,超过温度范围,催化剂活性降低 氨气在该反应条件下与氧气反应生成NO
在一定温度范围内催化剂活性较大,超过温度范围,催化剂活性降低 氨气在该反应条件下与氧气反应生成NO
【解析】
(1)①设NO的键能为x kJ/mol,反应2CO(g)+2NO(g)2CO2(g)+ N2(g) H=(1076![]() 2+2x)-(745
2+2x)-(745![]() 2
2![]() 2+945)=-746 kJ/mol,解得x=513.5,故NO的键能为513.5 kJ/mol;
2+945)=-746 kJ/mol,解得x=513.5,故NO的键能为513.5 kJ/mol;
②该反应为气体体积缩小的放热反应,若提高NO的平衡转化率,需要使平衡正向移动,采取的措施有:增大压强、降低温度、增大CO与NO的投料比等;
(2)①该反应是放热反应,升高温度不利于反应向右进行,会使平衡常数减小,曲线a符合此特点;
②由图可知,当温度在T2时,H2的转化率最高。温度越高反应速率越大,在相同时间内达到平衡状态前,H2的转化率最高,但达到平衡状态后继续升温,反应会向逆反应方形=向移动,导致H2的转化率降低,由图知b点为平衡状态;

同温同体积时压强比等于物质的量比,故b点时对应的压强与反应开始时的压强比为34:50=17:25;
(3)①NH3与NO2生成N2的反应方程式为8NH3+6NO2=7N2+12H2O,该反应中生成7mol N2时,转移的电子的物质的量为24mol,因此生成1mol N2时转移电子的物质的量为![]() =
=![]() mol;
mol;
②在一定温度范围内催化剂活性较大,超过温度范围,催化剂活性降低,由图可知迅速上升段是催化剂活性随温度升高而增大,与温度升高共同使NOx的去除反应速率增大;上升阶段缓慢主要是温度上高引起的NOx的去除反应速率增大但催化剂活性降低;在一定温度和催化剂存在的条件下,氨气能催化氧化生成NO,当温度高于380℃时,NOx的去除反应速率下降的原因可能是氨气在该反应条件下与氧气反应生成NO。