题目内容
【题目】按要求填空:
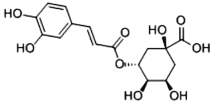
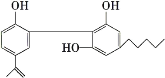
(1)运动员服用兴奋剂的现象在世界大赛中时有发生,某种兴奋剂的结构如图。回答下列问题。
①它的化学式为____。
②从结构上看,它属于___类。
③它所含的官能团的名称是___。
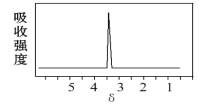
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图:则A的名称为___;请预测B的核磁共振氢谱上有___个峰(信号)。
【答案】C20H24O3 酚 碳碳双键、羟基 1,2-二溴乙烷 2
【解析】
(1)由有机物结构简式可知有机物含有的元素种类和原子数目,可确定有机物分子式,有机物中含有苯环和碳碳双键、酚羟基,以此解答该题;
(2)核磁共振氢谱中峰值数等于有机物中氢原子的种类数,核磁共振氢谱中只给出一种峰,说明该分子中只有1种H原子,然后根据分子式写出A、B对应的结构,再根据有机物命名原则写出A的名称,根据B分子中含有H原子种类判断该有机物核磁共振氢谱上的吸收峰数目。
(2)①由有机物的结构简式可知该有机物的分子式为:C20H24O3;
②根据图2可知,该兴奋剂分子中含酚-OH,属于酚类物质;
③它所含的官能团的名称是碳碳双键、羟基;
(3)核磁共振氢谱中只给出一种峰,说明该分子中只有1种H原子,则A的结构简式为:CH2BrCH2Br,其名称为:1,2-二溴乙烷;B的结构简式为CH3CHBr2,B分子中有两种H原子,所以核磁共振氢谱上有2个峰;

【题目】CH3COOH、H2CO3、H2SO3的电离常数如表所示。
酸 | 电离常数 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 ,K2=1.02×10-7 |
请回答下列问题:
(1)①NaHSO3溶液中电荷守恒表达式_____。
②NaHSO3溶液中各离子浓度大小顺序:_____。
(2)①用离子方程式表示Na2CO3溶液碱性的原因_____。
②写出Na2CO3溶液中物料守恒表达式______。
③写出NaHCO3溶液中质子守恒表达式______。
(3)常温下,物质的量浓度相同的下列溶液:
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④NH4HSO4 ⑤(NH4)2Fe(SO4)2
溶液中c(NH4+)从大到小排列顺序为____(填序号)。
(4)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为____(填序号)。
(5)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):____,将AlCl3溶液蒸干,灼烧,最后得到的固体产物主要是____(填化学式)。
(6)证明CH3COOH是弱电解质的简单且可行的方法是:_____。
(7)下列混合溶液中,各离子浓度的大小顺序或等量关系正确的是____。
A.10 mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10 mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2 mol/LNaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
E.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO
【题目】“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)CO 还原 NO 的反应为 2CO(g)+ 2NO(g)2CO2 (g)+ N2 (g) H= -746kJmol-1。部分化学键的键能数据如下表(CO 以 C≡O 键构成):
化学键 | C≡O | N≡N | C=O |
E/(kJ·mol-1) | 1076 | 945 | 745 |
① 由以上数据可求得 NO 的键能为________________kJ·mol-1。
② 写出两条有利于提高 NO 平衡转化率的措施______________。
(2)一定条件下,向某恒容密闭容器中充入 x mol CO2 和 y mol H2,发生的反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH= 50 kJmol1。
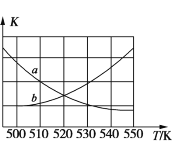
①图中能表示该反应的平衡常数 K 与温度 T 之间的变化关系曲线为____________ (填“a”或“b”),其判断依据是________ 。
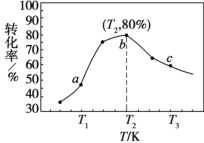
②若 x=2、y=3,测得在相同时间内不同温度下 H2 的转化率如图所示,则在该时间段内, 恰好达到化学平衡时,此时容器内的压强与反应开始时的压强之比为________。
(3)在有氧条件下,新型催化剂 M 能催化 NH3 与 NOx 反应生成 N2。
① NH3 与 NO2 生成 N2 的反应中,当生成 28g N2 时,转移的电子数为_______________mol(结果保留三位有效数字)。
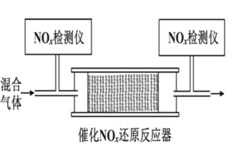
② 将一定比例的 O2、NH3 和 NOx 的混合气体,匀速通入装有催化剂 M 的反应器中反应(装置如图)。
反应相同时间 NOx 的去除率随反应温度的变化曲线如图所示:
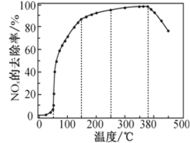
在 50~250 ℃范围内随着温度的升高,NOx 的去除率先迅速上升后上升缓慢的主要原因是_______________;当反应温度高于 380 ℃时,NOx 的去除率迅速下降的原因可能是_________。