题目内容
实验室用98%(密度为1.84g/mL)的浓硫酸配置成1mol/L的稀硫酸90mL.
(1)需用浓硫酸 mL.
(2)配置该溶液,除了烧杯、玻璃棒、量筒、还需要的玻璃仪器有 .
(3)容量瓶在使用前必需的一步操作是 .
(4)下列操作对硫酸的物质的量浓度有何影响(填“偏高”、“偏低”、“无影响”).
①未等稀释后的硫酸冷却至室温就转移到容量瓶中: .
②容量瓶中原有少量蒸馏水 .
③定容时仰视观察液面 .
(1)需用浓硫酸
(2)配置该溶液,除了烧杯、玻璃棒、量筒、还需要的玻璃仪器有
(3)容量瓶在使用前必需的一步操作是
(4)下列操作对硫酸的物质的量浓度有何影响(填“偏高”、“偏低”、“无影响”).
①未等稀释后的硫酸冷却至室温就转移到容量瓶中:
②容量瓶中原有少量蒸馏水
③定容时仰视观察液面
考点:溶液的配制
专题:化学实验基本操作
分析:(1)根据c=
计算出浓硫酸的物质的量浓度,然后根据溶液稀释过程中溶质的物质的量不变计算出需要浓硫酸的体积;
(2)配制90mmL溶液,需要选用100mL容量瓶,根据配制100mL 1mol/L的稀硫酸步骤选用仪器,然后判断还缺少仪器名称;
(3)根据容量瓶的构造及正确使用方法进行判断;
(4)根据实验操作对物质的量浓度表达式c=
的影响进行判断.
| 1000ρw |
| M |
(2)配制90mmL溶液,需要选用100mL容量瓶,根据配制100mL 1mol/L的稀硫酸步骤选用仪器,然后判断还缺少仪器名称;
(3)根据容量瓶的构造及正确使用方法进行判断;
(4)根据实验操作对物质的量浓度表达式c=
| n |
| V |
解答:
解:(1)质量分数为98%(密度为1.84g/mL)的浓硫酸的物质的量浓度为:c=
mol/L=18.4mol/L,
配制90mL的溶液,由于实验室没有90mL容量瓶,所以配制时应该选用100mL容量瓶,配制100mL 1mol/L的稀硫酸需要改浓硫酸的体积为:
≈0.0054L=5.4mL,
故答案为:5.4;
(2)根据配制步骤可知,配置该溶液,除了烧杯、玻璃棒、量筒、还需要100mL容量瓶及定容时必须使用的玻璃仪器-胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
(3)容量瓶有瓶塞,配制过程中需要摇匀,所以使用容量瓶前必须检查容量瓶是否漏水,
故答案为:检漏;
(4)①未等稀释后的硫酸冷却至室温就转移到容量瓶中,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,溶液的浓度偏高,
故答案为:偏高;
②容量瓶中原有少量蒸馏水,对溶质的物质的量及最终溶液的体积都没有影响,所以不影响配制结果,
故答案为:无影响;
③定容时仰视观察液面,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低,
故答案为:偏低.
| 1000×1.84×98% |
| 98 |
配制90mL的溶液,由于实验室没有90mL容量瓶,所以配制时应该选用100mL容量瓶,配制100mL 1mol/L的稀硫酸需要改浓硫酸的体积为:
| 1mol/L×0.1L |
| 18.4mol/L |
故答案为:5.4;
(2)根据配制步骤可知,配置该溶液,除了烧杯、玻璃棒、量筒、还需要100mL容量瓶及定容时必须使用的玻璃仪器-胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
(3)容量瓶有瓶塞,配制过程中需要摇匀,所以使用容量瓶前必须检查容量瓶是否漏水,
故答案为:检漏;
(4)①未等稀释后的硫酸冷却至室温就转移到容量瓶中,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,溶液的浓度偏高,
故答案为:偏高;
②容量瓶中原有少量蒸馏水,对溶质的物质的量及最终溶液的体积都没有影响,所以不影响配制结果,
故答案为:无影响;
③定容时仰视观察液面,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低,
故答案为:偏低.
点评:本题考查了配制一定物质的量浓度的溶液的方法,试题基础性强,贴近高考,该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.

练习册系列答案
相关题目
下列说法中,能够判断一个反应是否是氧化还原反应的是( )
| A、反应前后,元素是否有电子转移 |
| B、反应前后,元素是否有化合价变化 |
| C、反应前后,是否有氧元素参加 |
| D、反应前后,是否有氢元素参加 |
正确掌握化学用语和化学基本概念是学好化学的基础.下列有关表述中正确的一组是( )
| A、16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 |
| B、SiH4、PH3、HCl的稳定性逐渐增强 |
| C、氧化铁的化学式:FeO |
D、Ca2+的结构示意图为 ,NH4Cl的电子式为 ,NH4Cl的电子式为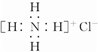 |
下列有关pH或c(H+)变化的判断中,正确的是( )
| A、温度升高,纯水的pH不变 |
| B、加水稀释,碳酸钠溶液的c(H+)减小 |
| C、温度升高,硫酸溶液的c(H+)基本不变 |
| D、pH=5的盐酸稀释1000倍后,溶液的pH变为8 |
