题目内容
【题目】金属铁盐或其氧化物在生产生活和科学实验中应用广泛。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3 CH4(g)![]() 2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
②若该反应在5L的密闭容器中进行,1min后达到平衡,测得体系中固体质量减少0.96g。则该段时间内CO的平均反应速率为__________。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是______(选填序号)
a.c(CH4)=c(CO)
b.固体的总质量不变
c.v(CO)与v(H2)的比值不变
d.混合气体的平均相对分子质量不变
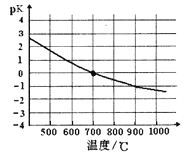
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。试用平衡移动原理解释该曲线的变化规律:______________________。若700℃时测得c平衡(H2)=1.0mol·L-1,则CH4的转化率为_________。
(2)菱铁矿的主要成分是:FeCO3,实验室中可以通过FeSO4与NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为:____________________。已知Ksp[FeCO3]=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_____________________。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备, 写出阳极电极反应式:_____________________。
【答案】 > 0.012mol·min-1 bd 该反应为吸热反应,温度越高反应进行的程度越大,K越大,则pK越小 50 % Fe2++2HCO3-=FeCO3↓+CO2↑+H2O K=[H2CO3]/[Fe2+]·[HCO3-] 2=Ka2/Ksp[FeCO3] ·Ka1=4.08×106>105,所以易发生 Fe-6e-+8OH-=FeO42-+4H2O
【解析】(1)①已知:ⅠFe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
ⅡCH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
ⅢCO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
根据盖斯定律可知反应Ⅰ+Ⅱ×3-Ⅲ×3即得到反应Fe2O3(s)+3CH4(g)![]() 2Fe(s)+3CO(g) +6H2(g)的△H=+714.6 kJ/mol >0;
2Fe(s)+3CO(g) +6H2(g)的△H=+714.6 kJ/mol >0;
②若该反应在5L的密闭容器中进行,1min后达到平衡,测得体系中固体质量减少0.96g,根据方程式可知减少的质量即为氧化铁中氧原子的质量,物质的量是0.06mol,所以生成CO是0.06mol,则该段时间内CO的平均反应速率为0.06mol/(5L×1min)= 0.012mol·min-1。③a.c(CH4)=c(CO)不能说明正逆反应速率相等,则不一定处于平衡状态,a错误;b.固体的总质量不变说明反应达到平衡状态,b正确;c.v(CO)与v(H2)的比值始终是1:2,不能据此说明反应达到平衡状态,c错误;d.混合气体的质量和物质的量均是变化的,因此混合气体的平均相对分子质量不变说明反应达到平衡状态,d正确,答案选bd;④由于该反应为吸热反应,温度越高反应进行的程度越大,K越大,则pK越小;若700℃时测得c平衡(H2)=1.0mol·L-1,此时pK=0,即K=1。
Fe2O3(s)+3CH4(g)![]() 2Fe(s)+3CO(g) +6H2(g)
2Fe(s)+3CO(g) +6H2(g)
起始浓度(mol/L) x 0 0
转化浓度(mol/L) 0.5 0.5 1
平衡浓度(mol/L) x-0.5 0.5 1
则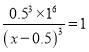 ,解得x=1,所以CH4的转化率为50%。(2) FeSO4与NaHCO3溶液混合可制得FeCO3,反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O。已知Ksp[FeCO3】=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。由于K=[H2CO3]/[Fe2+]·[HCO3-] 2=Ka2/Ksp[FeCO3] ·Ka1=4.08×106>105,所以该反应能进行。(3)阳极发生铁失去电子的氧化反应转化为高铁酸根,电极反应为Fe-6e-+8OH-=FeO42-+4H2O。
,解得x=1,所以CH4的转化率为50%。(2) FeSO4与NaHCO3溶液混合可制得FeCO3,反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O。已知Ksp[FeCO3】=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。由于K=[H2CO3]/[Fe2+]·[HCO3-] 2=Ka2/Ksp[FeCO3] ·Ka1=4.08×106>105,所以该反应能进行。(3)阳极发生铁失去电子的氧化反应转化为高铁酸根,电极反应为Fe-6e-+8OH-=FeO42-+4H2O。

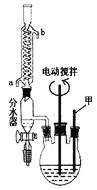
【题目】苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理、有关数据及装置示意图如下:


名称 | 性状 | 熔点/℃ | 沸点/℃ | 密度(g/mL) | 水溶性 |
甲苯 | 无色易挥发液体 | -95 | 110.6 | 0.8669 | 不溶 |
苯甲酸 | 白色晶体 | 112.4 | 248 | 1.2659 | 微溶 |
苯甲酸在水中的溶解度表:
温度/℃ | 25 | 50 | 95 |
溶解度/g | 0.344 | 0.849 | 6.8 |
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:
一、制备苯甲酸
在三颈瓶中加入2.7mL甲苯、100mL水和2~3片碎瓷片,开动电动搅拌器,a中通入流动水,在石棉网上加热至沸腾,然后分批加入8.5g KMnO4(过量),继续搅拌约4~5 h,直至反应完全,停止加热和搅拌,静置。
二、分离提纯
将反应混合液放在冰水浴中冷却,然后用稀硫酸酸化,苯甲酸全部析出后减压过滤,将沉淀物用少量冷水洗涤,干燥,得到粗产品。
三、测定纯度
称取m g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3指示剂,然后用标准浓度KOH溶液滴定。
请回答下列问题:
(1)仪器a的名称是____________,其作用为_________________________。
(3)分离提纯阶段产品减压过滤时用冷水洗涤的原因是______________________________。
(4)进一步提纯苯甲酸粗产品的操作是_____________。
(5)测定纯度阶段,所选的指示剂为_________,滴定终点的现象是________________。若m=1.200 g,滴定时用去0.1200 mol/L标准KOH溶液20.00 mL,则所得产品中苯甲酸的纯度(质量分数)为_________。